Prof.Dr. Kaan Aydos
İdiyopatik erkek infertilitesinde, izah edilemeyen infertilite olgularında ya da tedavisi olmayan veya cerrahi ya da medikal yöntemlerle başarılı olunamamış durumlarda ÜYT’ler kullanılabilir (Tablo 1). Teknik olarak sadece spermin manipüle edildiği yöntemlerden sperm, yumurta ve/veya embriyoların manipüle edildiği daha sofistike yöntemlere kadar geniş bir spektrum gösterir. Fertilizasyon intrauterin inseminasyonda olduğu gibi ya kadın vücudu içerisinde (in vivo) ya da IVF/ICSI’deki gibi laboratuvar ortamında (in vitro) gelişebilir. ÜYT’de kadının hazırlanmasında gonadotropinler kullanılarak hormonal stimülasyon ile süperovulasyonun sağlanması, yani kontrollü ovarian hiperstimülasyon, çoğu ÜYT’lerde kritik rol oynar.
Tablo 1. ÜREMEYE YARDIMCI TEKNİKLER VE KISA YAZILIŞLARI
| İntrauterin inseminasyon | IUI |
| İn vitro fertilizasyon | IVF |
| İntrasitoplazmik sperm enjeksiyonu | ICSI |
| Mikrocerrahi olarak epididimal sperm aspirasyonu | MESA |
| Perkütan sperm aspirasyonu | PESA |
| Testiküler sperm ekstiraksiyonu | TESE |
| Testiküler sperm aspirasyonu | TESA |
Günümüzde 3 çeşit ÜYT uygulaması yapılmaktadır: IUI, IVF ve ICSI. IUI; kısaca spermin yıkanarak iyi motilite ve morfolojideki spermatozoanın konsantre halde uterus içerisine bir kanül vasıtasıyla verilmesi işlemidir. Konvansiyonel IVF ise, kadından toplanan oositlerin bir petri kutusu içerisinde spermatozoa ile 24-48 saat inkübe edilmesi, arkasından oluşan embriyoların uterus kavitesine transferini içerir. ICSI’nin uygulanmaya başlamasından sonra konvansiyonel IVF daha az yapılır duruma gelmiştir. Çoğu klinik, IVF demekle ICSI işlemini kastetmektedirler. Bazı otörler eğer yeteri kadar oosit toplanabilmişse, bunların yarısına konvansiyonel IVF geri kalanına ise ICSI yapmayı tercih ederler. Öncelikle IVF’den elde edilen embriyoların transfer edilmesi önerilmektedir.
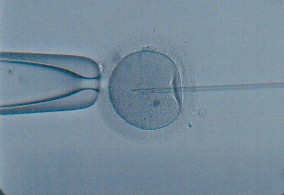 ICSI; tek bir spermatozoanın oosit içerisine mikroskop altında mikroenjeksiyonudur. IUI için yıkama sonrası ileri motil en az 5 milyon spermatoza gerekmekteyken, ICSI’de tek bir spermatozoa bile yeteli olur. Ancak gerek kanıta-dayalı tıp gerekse maliyet açısından her infertilite olgusunda ICSI yapılması hatadır. Özellikle tetkik sonuçları erkek faktörüne işaret ediyorsa veya daha önceki fertilizasyon denemeleri başarısız kalmışsa ICSI düşünülmeli, izah edilemeyen infertilite ve kadın faktörü olgularda doğrudan ICSI’ye geçilmeyip, diğer yöntemler denenmelidir.
ICSI; tek bir spermatozoanın oosit içerisine mikroskop altında mikroenjeksiyonudur. IUI için yıkama sonrası ileri motil en az 5 milyon spermatoza gerekmekteyken, ICSI’de tek bir spermatozoa bile yeteli olur. Ancak gerek kanıta-dayalı tıp gerekse maliyet açısından her infertilite olgusunda ICSI yapılması hatadır. Özellikle tetkik sonuçları erkek faktörüne işaret ediyorsa veya daha önceki fertilizasyon denemeleri başarısız kalmışsa ICSI düşünülmeli, izah edilemeyen infertilite ve kadın faktörü olgularda doğrudan ICSI’ye geçilmeyip, diğer yöntemler denenmelidir.
Aşağıdaki durumlarda ÜYT endikasyonu vardır:
· Ürolojik ya da medikal tedavilerin başarılı olmadığı durumlar
· İzah edilemeyen infertilite olguları
· Temel sperm parametrelerinde orta ya da şiddetli bozukluk bulunması
· Sperm fonksiyon testlerinde patolojik sonuç alınması
Sperm yıkandıktan sonra ileri motil (a+b kategorisinde) total sperm sayısı >5 milyon ise 4-6 siklus IUI ile tedaviye başlanılır. Ancak kadının yaşı >35 ise, IVF/ICSI tercih edilebilir. Total motil sperm sayısının <5 milyon ve morfolojisinin de %4-%14 arasında olduğu olgularda konvansiyonel IVF önerilir. Sperm konsantrasyonu arttıkça, fertilizasyon başarısı da artmaktadır.
ICSI ise i) total motil sperm sayısının < 1.5 milyon olduğu; ii) sınırda ya da düşük sperm konsantrasyonu ile birlikte normal sperm morfolojisinin de <%4 bulunduğu; iii) hemizona testinde (HZA) sperm-zona pellusida bağlanma kapasitesinin <%30 olduğu; iv) sperm parametrelerinin bozuk olduğu ve IUI ile başarısız kalındığı; v) antisperm antikor pozitif olup IUI ile cevap alınamadığı; vi) daha önce yapılan konvansiyonel IVF ile fertilizasyonun sağlanamadığı olgular ile vii) testis ya da epididimden spermin elde edilip ICSI planlanan olgularda endikedir. Şiddetli oligoastenoteratozoospermi bulunması ya da sperm fonksiyon testlerinde fertilizasyon kapasitesinin ciddi bozuk çıkması durumlarında doğrudan ICSI önerilebilir. Özellikle 35 yaş üzeri kadınlarda ICSI hem cost-efektif hem de zaman kaybını önleyen bir yöntem olma özelliğindedir.
Hafif ya da orta şiddette erkek faktörüne bağlı infertilitesi bulunan çiftler için IUI veya IVF uygun bir tedavi seçeneğidir. Maliyeti daha az olduğundan IUI sıklıkla ilk alternatiftir. Eğer sonuç alınamazsa IVF/ICSI’ye geçilir. Manipülasyon yapılmadan spermin oositi fertilize edemeyeceğine inanılıyorsa, o zaman tedaviye ICSI ile başlanılabilir. Bu durum, IUI veya standart IVF için yetersiz sayıda motil spermin bulunduğu şiddetli erkek faktörü infertilite olgularını içerir. Ayrıca, sperm fonksiyon testleri bozuk çıkan olgular da IUI yerine IVF/ICSI ile tedaviye başlayabilirler. Eğer başlangıç tedavisi olarak IVF/ICSI yapılmış ama fertilizasyon görülmesine rağmen gebelik gelişmemiş ise, daha sonra yine IVF/ICSI ile devam etmek yerine çiftler IUI’ı düşünebilirler.
ÜYT’de kullanılmadan önce semenin hazırlanması gerekir. Bu yöntemlerin hepsinde de seminal plazma ortamdan uzaklaştırılırken, motilitesi bulunmayan spermler ve lökositler elimine edilerek motil sperm seçimi yapılır.
Spermin yıkanarak hazırlanmasında sıklıkla 4 metod kullanılır:
1. Swim-up (yüzdürme) tekniği
2. Standart yıkama yöntemi (santrifüj ve yüzdürme)
3. Gradient tekniği
4. Mini-gradient yöntemi
Swim-up (yüzdürme) yöntemi: Tüm ejakulat 0.5-1 ml’lik fraksiyonlar halinda ayrı ayrı konik tüplere konulur. Üzerlerine sperm yıkama mediumu eklenir. Tüpler 37oC’da 1-2 saat süreyle %5 karbondioksitli ortamda 45o eğimli pozisyonda inkübe edilir. İnkübasyon sonunda üstteki 1ml’lik kısım pipetle alınarak kullanılır. Bu yöntemin sakıncası, ileri derecede oligozoospermi ya da astenozoospermi olgularında yeteri kadar sperm elde edilememesidir.
Standart yıkama yöntemi (santrifüj ve yüzdürme): Likefiye olmuş semen konik bir tüp içerisinde 1 : 1-2 volüm oranında sperm yıkama mediumu ile karıştırılır. 200-300 x g’de, 10-15 dakika santrifüj edilir. Üstteki supernatant kısmı atılarak, dipte kalan pellet medium ile tekrar karıştırılarak kullanılabilir. Bu işlem 2 kez tekrarlanabilir ya da ileri derecede oligozoospermi olgularında sadece 1 kez yapılarak bırakılır. İstenilen olgularda, alttaki pellet kısmının üzerine 1-2 ml medium konularak, 37oC’da 1-2 saat süreyle %5 CO2 ortamında inkübe edilir ve daha sonra üstteki 1 ml kısım pipet yardımıyla alınarak kullanılır. Bu şekilde daha fazla sayıda motilitesi iyi sperm elde edilmiş olunur.
Gradient tekniği: Burada silica partiküller içeren gradient mediumlar kullanılır. 15 ml’lik konik tabanlı Falcon tüpü içerisine, aşağıdan yukarıya doğru her birinden 1 ml olacak şekilde %90, %70 ve %50’lik gradient solüsyonları üst üste konularak 3 tabakalı yıkama yapılabilir veya sadece 2-3 ml %80 ve 2-3 ml %40’lık iki tabaka ile hazırlanmış yıkama da kullanılabilir. En üstteki tabakanın üzerine, her bir gradient tabakası için 1 ml olacak şekilde, 2-3 ml likefiye olmuş ejakulat sarsmadan bırakılır. 200-500 x g’de 10-20 dakika santrifüj edilir. Daha sonra, en alttaki fraksiyon (kullanılan gradient miktarına göre 1 ya da 2-3 ml) geride bırakılarak üstteki supernatant kısmı bir pipetle aspire edilerek dışarı atılır. Dipte bırakılan kısım, 1 : 1 volüm medium ile karıştırılarak yukarıda tarif edildiği şekilde yıkanır ve altta toplanan pellet kullanılır.
Mini-gradient yöntemi: İleri derecede oligozoospermi olgularında yukarıda tarif edilen gradient tekniği modifiye edilerek uygulanmalıdır. Her bir gradient tabakasından 0.3 ml konulur. Burada kullanılacak sperm, önce 100 x g’de 10 dakika yıkanmalı ve bu şekilde volümü azaltılmalı, daha sonra gradient solüsyonlarının üzerine konulmalıdır. İşlemin diğer basamakları aynen uygulanır.
Gradient yöntemlerinde, spermler partiküllerin arasından aşağıya doğru yüzerek dipte toplanırlar, yani sadece gravidite değil spermatozoanın kendimotilitesi de sperm seçiminde etkili olur. Ayrıca bu yöntemde, akrozom membranı üzerine olan mekanik etkinin de fertilizasyonu arttırıcı etkisi bulunduğu ileri sürülmektedir. İmmatür hücrelerin ve lökositlerin de ortamdan uzaklaştırılmaları, bunlardan açığa çıkabilecek serbest oksijen radikallerini azaltarak, fertilizasyonu düzeltiyor da olabilir. Bir diğer önemli husus ise santrifüj hızıdır. Yüksek hız kullanılırsa, immotil spermler ve debrisler de dibe çökebileceklerinden, kaliteli sperm elde edilmesini önleyebilir.
Gradient yönteminde gradient solüsyonları üzerine sperm konulduktan sonra uygulanacak santrifüjün süresi çok önemlidir. Öncelikle motil olan spermler dipte toplanacağından, sürenin uzaması halinde nonmotil hücreler ve debrisler de dipte birikeceklerdir. Genel olarak, normal sperm parametrelerinde 10-20 dakika, orta derecede bozulmuş olanlarda 10-30 dakika, ileri derecede bozuk sperm örneklerinde ise 15-45 dakika santrifüj edilmeleri önerilir. Viskozitesi artmış spermler, motilitesi %20’den az olan spermler ve hücre sayısı 20 milyon/ml’den fazla olan spermlerin de uzun süreli santrifüj edilmeleri gerekir. Normal morfoloji oranları düşük spermlerin ise daha kısa süreli santrifüj edilmeleri uygun olur.
İntrauterin İnseminasyon
IUI’da, hazırlanmış sperm küçük bir katater yardımıyla serviksden geçirilerek uterus kavitesine bırakılır. Servikal mukusun bu şekilde atlanması ile, daha fazla sayıda motil spermin fallop tüplerine erişmesi ve böylece gebelik şansının da artması beklenmektedir. Gerek seminal plazma içerisindeki prostaglandinler uterusda şiddetli kramplara neden olacağından gerekse seminal sıvıdaki bakterilerin pelvik enfeksiyon yapma riski bulunduğundan, semenin hazırlanmadan kullanılması kontrendikedir.
IUI sırasında spermin yıkanarak hazırlanmasının faydaları aşağıda yazıldığı gibidir:
· Prostaglandin ve diğer inhibitör maddelerin spermden uzaklaştırılması
· İleri-motil spermatozoaların konsantre edilerek toplanması
· Spermatozoaların motilite ve ileri hareketlerini artırmak
· Seminal plazma volümünü, uterusa verilebilecek miktara kadar azaltmak
Erkek faktörü infertilite, izah edilemeyen infertilite, servikal mukus bozuklukları, ve spermin serviks ağzında depolanmasını önleyen anatomik bozuklukların (şiddetli hipospadias, retrograd ejakulasyon, ve bazı erektil disfonksiyon olguları) hepsi de IUI için endikasyon oluştururlar. Ayrıca, servikal faktör infertilitesi, disparoni gibi vajinal girişi engelleyen anatomik bozukluklar ve psikojenik seksüel disfonksiyon da IUI’ın diğer endikasyonlarıdır.
IUI yapılacak kadın ya doğal olarak ovulasyona bırakılır (doğal-siklus ile IUI) ya da çok sayıda yumurtanın maturasyonunu stimüle etmek için ilaç kullanabilir (süperovulasyon ya da kontrollü ovarian hiperstimülasyon). Esas olarak semenin vajende yeterli depolanmasında problem bulunan (hipospadias, ejakulasyon bozuklukları, seksüel fonksiyon bozuklukları) olgularda doğal-siklus ile IUI gerekir. Kontrollü çalışmaların büyük kısmında, semen parametreleri bozulmuş erkek faktörü infertilite olgularında doğal-siklus ile IUI’ın faydası bulunduğu gösterilememiştir. Dondurulmadan önce normal semen parametreleri saptanmış kryoprezervasyon spermlerinde de doğal-siklus ile IUI endikedir. Benzer şekilde, donör inseminasyonu veya kemoterapi ya da radyoterapi öncesi dondurularak saklanmış spermler için de aynı uygulama gerekir.
Erkek faktörü bulunan çiftlerde doğal-siklus ile IUI’ın kötü sonuçlar vermesi nedeniyle, sıklıkla ovulasyon indüksiyonu da eklenir. Çok sayıda kontrollü çalışma yapılmış olup, büyük kısmında bu yaklaşımın gebelik oranlarını düzelttiği ortaya konmuştur.
Ovulasyon indüksiyonu klomifen sitrat gibi oral ilaçlarla yapılabildiği gibi, gonadotropin enjeksiyonlarıyla da yapılabilir. Yakın tarihli yayınları içine alan bir derleme, erkek faktörü bulunan çiftlerde yalnız koit ile gebelik oranlarının siklus başına %1-3 olduğunu önermektedir. Semen parametreleri suboptimal ise doğal-siklus ile IUI yapıldığında bu oranlar düzelmemektedir. Oysa ovulasyon indüksiyonu ile birlikte IUI yapıldığında gebelik oranları bazal değerlerin üzerine çıkmaktadır.
Erkek faktörü infertilite olgularında her ne kadar klomifen sitrat ile stimülasyonun gerçekleştirildiği sikluslara ait veriler çok açık değilse de, bunlarda siklus başına sıklıkla %5-8 arasında değişen gebelik oranları elde edilmektedir. Gonadotropin ile ovulasyon indüksiyonu yapılmış IUI’larda ise siklus başına ortalama %10-15 gebelik görülmektedir. 3 kez IUI uygulanmasını takiben kümülatif gebelik oranları %25 civarındadır. Antisperm antikor varlığına karşı bir önlem olarak sperm toplama kabı içerisine sperm hazırlama mediumu konularak, fertilizasyon başarısının artırılacağı ileri sürülmektedir. Bu yöntemle 3 kez IUI’dan alınan kümülatif gebelik oranı %64; bir siklus IVF uygulamasında da %44 gebelik sağlanılabilir.
Çalışmaların çoğunda, gebeliklerin büyük kısmı ilk üç siklus sırasında görülür. Bundan sonraki sikluslarda özel indüksiyon şemaları uygulanarak çok az sayıda gebelik gelişebilmektedir. Böylece, tedaviye sıklıkla birkaç ay süresince klomifen sitrat siklusları ile başlanılır. Eğer gebelik gelişmez ise, 3 siklusa kadar gonadotropinlerle ovulasyon indüksiyonu yapılarak devam edilir.
IUI ile gebelik başarılamamışsa, IVF düşünülmelidir. Aynı koit sonrasında olduğu gibi, IUI’dan sonra da gebeliğin oluşabilmesi için gerekli belirli bir minimum sperm sayısı bulunmamaktadır. 1 milyon motil spermin altında yapılan inseminasyonlarda gebelik oranları anlamlı derecede düşmektedir. Motil sperm sayısının 10-20 milyon/ml’ye kadar yükselmesi ile gebelik oranları da artabilir, ama bundan sonra oranlar bir plato oluşturur.
Semen hazırlandıktan sonra en az 1 milyon ileri-motil (a+b) spermin elde edildiği çiftlere IUI önerilmelidir. Semen hazırlanırken spermin sadece %10-20’si elde edilebildiği için, semende hazırlama öncesi genellikle en az 5-10 milyon motil sperm bulunmalıdır. IUI komplikasyonları; genellikle sınırlı gelişen uterus krampları, hastaların %0.5’inden azında pelvik enfeksiyon ve nadiren inseminasyon medyumuna karşı allerjik reaksiyonlardır.
Her ne kadar ovulasyon indüksiyonu gebelik oranlarını yükseltmekteyse de, sonuç alınan olguların %15-30’unda çoğul gebelikle sonuçlanmaktadır. Çoğul gebeliklerin ise yaklaşık %80’i ikiz, %12’si de üçüz olup, %7’sinde üçün üzerinde gebelik kesesi gözlenir.
Erkekte HIV pozitif olması durumunda dikkatli olunmalıdır. HIV-1-enfeksiyonlu erkeklerin semenlerinde lökositler içinde bulunmasının yanı sıra, HIV semende serbest halde de bulunmuştur. Her ne kadar birkaç merkez viral partikülleri uzaklaştırmak amacıyla semeni hazırladıktan sonra başarıyla IUI’da kullandıklarını bildirmiş olsalar da, bu yaklaşımın güvenilirliliğinin ispatlanması için daha fazla çalışmaya ihtiyaç vardır.
İn Vitro Fertilizasyon ve ICSI
İnfertil çiftlerin tedavisinde IVF kullanımı artarak yaygınlaşmıştır. Çoğu merkez oosit sayısını artırmak için gonadotropinler ile superovulasyonu tercih etmektedir. IVF’de follikül gelişimi ultrason ile takip edilir ve henüz ovulasyon olmadan önce ultrason altında iğne aspirasyonu yapılarak yumurta toplanır. Elde edilen yumurtalar, hazırlanmış sperm ile biraraya getirilerek in vitro inseminasyon gerçekleştirilir.
Konvansiyonel IVF’de, fertilizasyon olmuşsa, gelişen embriyolar 2-3 gün süreyle kültür ortamında bekletilirler ve arkasından transservikal yolla uterus içerisine nakledilirler. Ortalama 3-4 embriyonun transfer edilmesi önerilir. Transfer edilen embriyo sayısı daha az olursa gebelik şansı azalır, fazla olması durumunda ise çoğul gebelik gelişme olasılığı artar.. Nakledilen embriyoların sadece %20-30’u implante olacak ve klinik gebelikle sonuçlanacaktır.
Son yıllarda, embriyolar kültür ortamında 5 gün bekletilerek blastosist safhasına geldikten sonra da transfer edilmeye başlanılmıştır. Standart 3 günlük embriyo transferleri ile karşılaştırıldığında blastosist transferlerinin implantasyon oranları daha yüksek görülmektedir. Bu uygulamada daha az embriyo transferi yapıldığı için çoklu gebelik riski de az olmaktadır. İmplantasyon oranlarını düzeltmek amacıyla zona pellusidanın in vitro tekniklerle açılması (assisted hatching) da kullanılmaktadır. Bazı IVF hastaları bu uygulamadan fayda görebilir.
Sperm fonksiyonları normal ise, insemine edilen oositlerin %90’dan fazlası rutin olarak fertilize olurlar. Ancak, erkek faktörü varsa fertilizasyon oranları düşer. ICSI’de ise yumurta içerisine tek bir sperm enjeksiyonu yapılır. Bu yöntemle çok düşük sperm sayılarında bile fertilizasyon olanağı vardır. ICSI, daha önce kullanılan subzonal sperm enjeksiyonu ya da zona manipülasyonu ile gerçekleştirilen diğer tekniklerinin temelde yerini almıştır. Şiddetli erkek faktörü infertilite olgularında, regüler IVF sikluslarında fertilizasyonun gelişmediği ya da zayıf geliştiği olgularda, ya da spermin ciddi fertilizasyon defekti taşıdığı olgularda (yuvarlak-başlı sperm gibi) ICSI gerekir. Yuvarlak baş anomalisi gibi ciddi sperm morfoloji bozukluklarında ICSI’nin başarısı da düşmektedir.
Klinik gebelik ultrasonografi ile uterus içerisinde en az bir gebelik kesesinin gösterildiği gebeliği ifade eder. Bu durum, belki klinik gebeliğe hiç ulaşamayacak olan biyokimyasal gebelikten farklıdır. IVF sonuçları belirtilirken klinik gebelik değerleri kullanılmalıdır. Konvansiyonel IVF ile klinik gebelik oranları, her başlanılan siklus başına %20 ile %30 arasında değişir. IVF’de gebelik oranları üzerine kadın yaşının önemli etkisi bulunur. Örneğin, the Centers for Disease Control and Prevention verileri 1997 yılında yapılan IVF sikluslarında, 35 yaş altı kadınlarda gebelik oranlarını %35.7, 40 yaş üzerindekiler de ise %13.2 olarak bildirmiştir. ICSI ile de benzer ya da kısmen daha iyi sonuçlar elde edilmektedir. Ancak, gebelik oranlarının canlı doğum oranları olmadığını da unutmamak gerekir. Çünkü ovarian stimülasyona başlanılan kadınlarda siklusların hepsinde de oosit toplanıp embriyo transferi yapılamaz ve klinik gebeliklerin %15’i düşük ile sonuçlanır. Dolayısıyla, her ne kadar 35 yaş altı kadınlarda gebelik oranları %35.7 olsa da, canlı doğum oranı %30.7’dir. Daha önemlisi, 40 yaş üzeri kadınlarda gebelik oranı %13.2 iken, canlı doğum oranı sadece %7.6’dır.
Regüler IVF ile genelde 3-4 embriyo implante edilirken, blastosist transferlerinde genellikle sadece 2 embriyo transferi yapılır. Gebeliklerin %18-44’ü çoğuldur. Bunların büyük kısmı ikiz, %3-14’ü ise üçüz ya da üzerindedir.
ICSI’nin 1992 yılında Palermo ve ark. tarafından uygulanarak ilk gebeliğin elde edilmesi, infertilite tedavisinde yeni bir dönem başlatmıştır. Hemen arkasından, obstrüktif azoospermi olgularında epididimden veya testislerden elde edilen spermatozoalar kullanılarak ICSI denemeleri başlamış ve başarılı sonuçlar bildirilmiştir.
Ancak, primer testiküler yetmezliğe bağlı non-obstrüktif azoospermi olguları sperm elde edilmesindeki güçlükler nedeniyle en problemli olguları teşkil etmektedir. Testiküler sperm ekstraksiyonu (TESE) tekniğinde son yıllarda elde edilen ilerlemeler neticesinde bu olguların da %24-81’inda spermatozoa elde edilebilmekte ve %18 ile 38 arasında gebelik sağlanabilmektedir.
Yine de testis biyopsilerinde total germinal aplazi ya da maturasyon arresti bulunan olguların %58-76’sında, konvansiyonel ayrıştırma yöntemleri ile sperm elde edilmesinde başarısız kalınmaktadır.
Tese ile Hücre Elde Etme Başarısı Üzerine Prognostik Faktörler
Testislerden alınan doku örneklerinde matür sperm hücresi bulunup bulunamayacağının bazı tetkikler ile önceden belirlenmesi, gerek erkekte gerekse kadında ICSI uygulamasına ait olumsuz sonuçlarla karşılaşılmasını önleyecektir.
Serum inhibin B ve FSH ölçümleri
Follikül stimüle edici hormon (FSH); Sertoli hücreleri üzerinden hormonlar, büyüme faktörleri ve sitokinler gibi değişik proteinlerin yapımını uyararak ya da inhibe ederek spermatogenezi düzenler. Hipofizden FSH salınımı ise esasen Sertoli hücreleri tarafından yapılan inhibin B tarafından kontrol edilir. İnhibin B testosteron ile birlikte diürnal bir ritim gösterir. Sabah en yüksek değerine ulaşırken akşama doğru düşme eyilimindedir. Sağlıklı ve infertil erkeklerde inhibin B’nin sabah ölçülen serum konsantrasyonları FSH, sperm sayımı ve testis volümü ile de korele bulunmuştur.
İnhibin B salgılanmasının kontrolünde germ hücrelerinin de rolü bulunduğu ortaya konmuştur. Rat testisinde, seminifer tubüllerden inhibin B salgılanması esasen spermatidlerin varlığına bağlıdır. İnhibin B düşük ise, spermatidlerin de bulunmadığı sonucuna varılabilir. İnhibin B’nin düştüğü, FSH’nın ise yükseldiği erkeklerde spermatogenezin de büyük oranda bozulmuş olduğu düşünülebilir.
İnfertil erkeklerin tanısal araştırmalarında serum FSH ölçümü geniş çapta kullanılmakla birlikte, azoosperminin yapısı ve testis dokusunda spermatozoa varlığı bakımından sadece FSH’nın ölçülmesi yeterli olmamaktadır.
Azoosperminin şeklini inhibin B daha doğru yansıtır. Özellikle Sertoli cell only sendromu (SCOS)’nda muhtemelen Sertoli hücresindeki hasar nedeniyle serum konsantrasyonu en düşük seviyesine iner. Ancak serum FSH düzeyleri ile inhibin B düzeyleri arasında her zaman aynı uyum görülmeyebilir. Örneğin bazı oligozoospermik erkeklerde yükselmiş serum FSH’sı ile birlikte normal inhibin B düzeyleri bulunabilir. Dolayısıyla, ne çok yükselmiş serum FSH seviyesi ne de düşmüş inhibin B düzeyi TESE sırasında spermatozoa elde edilebileceğini ekarte etmemektedir.
Testis biyopsilerinin histopatolojik tanılarında, serum FSH ve inhibin B konsantrasyonları birbirleriyle ters korelasyon ortaya koyarlar. SCOS’da kontrol grubuyla karşılaştırıldığı zaman, inhibin B anlamlı düzeyde düşmektedir. Tanısal testis biyopsilerinde uzamış (elongated) spermatidlerin varlığını göstermede FSH ve inhibin B konsantrasyonlarının birlikte ölçümlerinin daha yüksek sensitivite ve spesifisiteye sahip oldukları bildirilmektedir. Benzer ilişki seminal plazma inhibin B seviyesi ile de gösterilmiştir.
Her ne kadar çalışmalar bu yönde olsalar da, ne inhibin B ne FSH ne de ikisinin birlikte ölçümü TESE sırasında matür sperm hücresi bulunabileceğini tahmin ettirmede yeterli değildirler.
Ejakulatta germ hücrelerinin bulunması
Ejakulatın May-Grünwald-Giemsa ile boyalı preparatlarında yuvarlak (round) spermatid bulunan olguların önemli bir kısmında testislerinden spermatozoa elde edilebileceği gösterilmiştir. TESE ile spermatozoa bulunan olguların %83’ünde ejakulatlarında yuvarlak spermatid ayırt edilmiş olmasına dayanılarak, ejakulatın boyalı preparatlarında spermatid aranmasının TESE sonucunu tahmin etmede yüksek duyarlılıkta, ekonomik ve invaziv olmayan bir yöntem olduğu ileri sürülmektedir.
Testis biyopsisi
Testis biyopsisi sonuçlarına bakarak TESE ile spermatozoa elde etme oranları karşılaştırıldığında, biyopsi sonucu komplet SCOS ya da komplet maturasyon duraklaması gelse bile, TESE sırasında bunların sırasıyla %19-33 ve %33-48’inde en azından bir spermatozoa bulunabilmektedir.
Biyopsilerin histopatolojik incelemeleri, germinal aplazi bulunan olgularda aynı zamanda komşu tubüllerde fokal normal spermatogenez odaklarının da bulunabileceğini göstermektedir. Böyle miks olgularda TESE ile %65’inde sperm bulunabilmektedir. Hatta, Klinefelter’s sendromu ve tubüler skleroz bulunan biyopsi olgularında bile sperm elde etmek mümkün olabilmektedir. Testis biyopsisi hipospermatogenez gelen olguların %85’i civarında, erken spermatid duraklaması olan olguların ise %80’inde TESE sırasında ICSI’de kullanılabilecek matür spermatozoa elde edilebilmektedir.
Ejakulata en az bir spermatozoanın erişebilmesi için testis biyopsisinde seminifer tubüli başına ortalama 3 veya daha fazla matür spermatid bulunması gerekmektedir. Bu eşik değeri aşan spermatid sayılması, ileride ICSI yapılacak azoospermik olgularda ejakulatlarında da detaylı arama ile spermatozoa bulunabileceğini belli etmesi bakımından değerli olabilir.
Bu sonuçlar tanısal amaçlı yapılan testis biyopsilerinin, TESE sırasında sperm elde etme başarısı üzerine tahminde bulundurabilecek sonuç vermeyeceğini, sadece başarı oranını belirlemede etkin olacağı kanısını vermektedir. Diğer yandan, tanısal amaçlı biyopsiler testislere ait başka patolojilerin, bazı sistemik hastalık tutulumlarının ve erken evre tümörlerin tanınmasında kuşkusuz faydalı olacaktır.
Y-kromozom delesyonları
TESE yapılacak olgularda daha önceden Y kromozomundaki delesyona uğramış bölgenin tespit edilmesinin, TESE sırasında hücre bulma şansını tahmin etmede prognostik öneme sahip olduğu ortaya konmuştur. AZFc bölgesini de içine alan kombine delesyonlarda (AZFb+c, AZFa+b+c) testiküler spermatozoaların total yokluğu söz konusudur. AZFc delesyonları genellikle hipospermatogenez ya da SCOS tip II’ye eşlik eder. SCOS tip II’de multipl biyopsiler alındığında normal spermatogenez gösteren izole adacıklar bulunabilir.Tek başına AZFc delesyonlarında ise %50 olguda matür spermatozoa bulunmaktadır.
AZFb delesyonlarının prognozu ise oldukça kötüdür. AZFb delesyonu gelen olgularda mayoz sırasında veya daha öncesinde spermatogenezde duraklama gelişmektedir. Ancak AZFb delesyonlarının da farklı subtipleri bilinmektedir. Bütün AZFb bölgesini kaplayan komplet delesyonlarında spermatosit veya spermatid seviyesinde duraklama oluşmaktadır.
Komplet AZFb delesyonu + AZFa ve/veya AZFc delesyonları ise SCOS ya da spermatogenetik duraklama ile birliktedir. Oysa yalnızca o bölgenin bir parçasının silindiği parsiyel AZFb delesyonlarında, oligozoospermiyi de içeren daha heterojen sonuçlar ortaya çıkmaktadır.
AZFa delesyonlarında da azoospermi bulunabilir. AZFa delesyonları çok nadir olup, SCOS tip I ile birlikte görülür.
Ancak, son çalışmalarda AZFa-b-c bölgelerinin tamamını içine alan delesyonlar dışındaki her türlü ikili kombine delesyonlarda TESE ile hücre bulunabileceği kanısı yaygınlaşmaktadır.
Testis Volümü Ölçümü
Testis içinde spermatogenezin topografik dağılımı volüm ile bir ilişki göstermediği için, TESE’de hücre bulma olasılığını tahmin etmede testis volümü tayini yol gösterici özelliğe sahip değildir. Histopatolojisi SCOS olmasına rağmen normal volüm gösteren bir testiste, spermatozoa bulma şansı da düşük olacaktır.
Diğer yandan, küçük volümlü bir testis, maturasyon duraklaması gösterse bile TESE’de hücre bulunamıyacağını da ifade etmez. Normal volümlü testislerin ancak %44’ünde sperm elde edilebilirken, çok küçük volümlü testislerin de %25’inde yine hücre bulunabileceği bildirilmiştir
Vimentin ve sitokeratin immünohistokimyasal analizi, Sertoli hücrelerinde lipid granüllerinin bulunması ve telomer ölçümü gibi yöntemlerin de kısmen TESE’de spermatozoa bulunması üzerinde prediktif değere sahip olabilecekleri öngörülmektedir.
Bazı otörler spermatogenezin tüm testis dokusu içinde multi-fokal dağılımına dayanarak, TESE için tek bir biyopsinin yeterli olacağını savunurlarken, diğerleri örneklemenin arttırılmasıyla sperm bulma şansının daha fazla olacağı görüşündedirler. Biyopsi sırasında örneklemenin arttırılması ise testisin kan dolaşımında bozulma ya da fibrozis ve immün hasar gibi yan etkilere yol açabilmektedir.
TESE’nin spermatogenez üzerine yaptığı zararlı etkilerin aylarca devam edebileceği göz önüne alınarak, aynı testise 6 ay geçmeden işlem uygulanmaması gerekmektedir. Diğer yandan, çok sayıda alınan biyopsilerin yapacağı zararlı etkileri en aza indirmek amacıyla mikrocerrahi yöntemler kullanılarak testis doku örneklerinin çıkarılması tekniği önerilmektedir.
SCOS (germinal aplazi); germ hücrelerinin komple bulunmadığı total ve bazı normal tubüllerin de eşlik ettiği parsiyel olmak üzere iki grup halinde sınıflandırılır. Parsiyel germinal aplazi olgularında multipl biyopsiler alındığında TESE ile %50’sinde spermatozoa elde edilebilmektedir. Bu oran komple aplazilerde son derece düşmektedir.
Tek bir biyopsi alındığında spermatogenezin varlığı gösterilememiş ise, bu durumda total germinal aplaziden söz etmek doğru olmayacaktır. Çünkü, biyopsi sayısı arttırıldıkça, spermatozoa bulma şansı da artmaktadır. Obstrüktif olmayan azoospermi bulunan hastalarda, özellikle maturasyon duraklaması ve kombine patolojilerin bulunduğu olgular olmak üzere, tek biyopsi ile %37.5 olguda spermatozoa elde edilirken, çoklu biyopsi örneklemesi ile bu oranın %49 gibi anlamlı bir yükselme göstermektedir. Ancak çoklu biyopsilemede biyopsi sayısının kaç olması gerektiği konusu oldukça tartışmalıdır.
Biyopsi sayısının arttırılması her ne kadar ICSI yapılma şansını da artıracak olmakla birlikte, bu işlem önemli riskler de taşımaktadır. Çoklu biyopsileme ile TESE yapılması neticesi testislerde total devaskülerizasyona kadar giden atrofik değişiklikler gelişebilir.
Yakın zamanlarda tanımlanan mikrocerrahi-TESE yöntemi, ICSI günü yapılan TESE sırasında spermatozoa bulamama olasılığına karşı hem hücre bulma şansını arttırmakta, hem de çoklu biyopsilemenin potansiyel zararlarından kişiyi korumaktadır. Mikrocerrahi-TESE ile spermatozoa elde etme oranının (%51) çoklu biyopsilemeden (%37) anlamı ölçüde yüksek bulunabileceği bildirilmektedir. Burada spermatozoa içeren matür tubüllerin mikroskop altında tanınabilmesi en önemli etkendir. Ameliyat mikroskopu altında matür seminifer tubüllerin ayırd edilebilmesi, çıkarılan doku volümünü de önemli ölçüde azaltır.
Diğer yandan, mikroskop altında gözlenebilen küçük damarlar ve kanama odakları da daha efektif kontrol edilebilirler. Seminifer tubüller mikroskop altında incelendiğinde, içerisinde spermatogenezin normal olduğu tubüller, çok miktarda hücre içermeleri nedeniyle, diğerlerine göre daha geniş, opak ve dolgun görülmektedirler. Sklerotik tubüller ise kollaps durumundadırlar.
Mikrocerrahi yöntemle yapılan TESE’nin, randomize çoklu testis biyopsilerine göre daha fazla oranda spermatozoa bulma şansı verebileceği, ve tanımlanan yöntemle yapılan mikroskopik-TESE’nin obstrüktif olmayan azoospermi olgularında hücre elde etmede daha etkili ve gerek çıkarılan doku hacminin azlığı, gerekse geride kalan testis dokusuna hemen hiç zarar vermemesi bakımlarından minimal invaziv bir yöntem olduğu düşünülmektedir.
TESE için alınan testis biyopsilerinde spermatozoa aranmasında sıklıkla mekanik ayrıştırma yöntemi kullanılmaktadır. Burada seminifer tubülilerin bazal membranları mekanik olarak parçalanarak, lümende bulunan az sayıdaki germ hücrelerinin ortama geçmeleri sağlanılmaktadır. Bu sırada spermatozoaların yanısıra yuvarlak germ hücreleri, interstisiyel hücreler ve Sertoli hücreleri de açığa çıkmaktadır. Ancak işlem sırasında bir kısım hücreler parçalanmakta ve ortama dejenere olmuş hücre artıkları, serbest nukleuslar ve rezidü doku parçaları ile toksik serbest oksijen radikalleri de çıkar. Diğer yandan, mekanik ayrıştırma yapıldıktan sonra bir miktar spermatozoa ve spermatidin Sertoli hücrelerinden ayrılmayarak yapışık kaldıkları ve lümene dökülmedikleri görülmektedir.
Mekanik parçalamadan başka, testis dokusundan hücre elde etmede kollagen liflerini ayrıştırmak ve hücreler arasındaki bağlantıları kopararak serbestçe lümene dökülmelerini sağlamak amacıyla enzimatik ayrıştırma teknikleri de denenmiştir. Bu amaçla trypsin-Dnase, trypsin tip III ve collagenase tip I ve tip IV kullanılmış ve başarılı sonuçlar bildirilmiştir. Kollagenaz; dokuların ayrıştırılmasında yaygın olarak kullanılan oldukça spesifik bir proteazdır. İnsanda da testislerden sperm elde edilmesinde başarıyla kullanılmıştır. Kollajenaz IV in vivo ortamda germ hücrelerinin yer değiştirmesinde ve spermiasyon sırasında matür spermatozoaların lümene salınmasında da rol oynar.
Ancak, hücre süspansiyonu ortamına enzim konmasının bu hücrelerin fertilizasyon kapasitelerini nasıl etkilediğinin daha geniş serilerde araştırılması gerekmektedir. Bu nedenle, non-obstrüktif azoospermi olgularında testis doku örneklerinin mekanik ayrıştırılması işleminin başarısız kaldığı durumlarda kollajenaz tip IV enzimi kullanılarak ayrıştırmaya devam edilmesinin, matür spermatozoa elde edilmesinde etkin bir yöntem olduğu söylenilebilir.
TESE ile Elde Edilen Hücrelerin in vitro Maturasyonunun Sağlanması
Spermatidlerin ICSI ile fertilizasyon şansının düşük kalmasının en önemli nedeni, yuvarlak (round) spermatid oluşumu sırasında henüz yeni başlamış olan nuklear proteinlerden histonların protaminler ile yer değiştirme işleminde yetersizlikten kaynaklanmaktadır. Normalde spermatid oosit içine girdiğinde, maturasyon uyarıcı faktörlerin etkisiyle proteinler arasındaki disülfit bağları kaybolarak dekondanse duruma geçer. Eksperimental çalışmalarda sperm nukleusunda dekondensasyonun başlaması için 45-60 dk. geçmesi gerektiği ortaya konmuştur. Bu gecikme süresi normal pronukleusun gelişebilmesi için şarttır.
Erken spermatid döneminde olduğu gibi, protaminlerin henüz oluşmadığı ya da yetersiz olduğu nukleuslarda dekondensasyon çok erken gelişerek prematür dekondensasyon denilen patolojik durum ortaya çıkar. Bu nedenle, başarılı bir fertilizasyonun sağlanabilmesi için mikroenjeksiyondan önce oosit ya stimüle edilerek aktif hale getirilmeli veya maturitesinin tamamlanabileceği bir süre geçmesini bekledikten sonra enjeksiyon yapılmalıdır. İşte bu nedenle, in vitro şartlarda germ hücrelerinin yeterli maturasyonlarının sağlanması yoluyla ICSI’de fertilizasyon şansının artırılması önerilmiştir.
Her ne kadar yuvarlak spermatid enjeksiyonu ile gebelik elde edilmiş ise de, yuvarlak ve uzamış (elongated) spermatid mikroenjeksiyonları ile elde edilen fertilizasyon ve gebelik oranları arasındaki farklılıklar ve bu immatür hücrelerin taşıdığı potansiyel riskler, spermatid kullanımını henüz üzerinde geniş araştırmaların yapılması gerekli bir konu haline getirmektedir.
Normalde haploid hücreler olan spermatosit ve spermatidler oosit içerisine girdiklerinde, oosit aktivasyonu gelişerek ikinci mayoz bölünmelerini tamamlar. Oysa spermatositler henüz mayozunu tamamlamamış diploid sayılan bir basamakta bulundukları için, bunların in vitro şartlarda haploid hale getirilmeleri gerekir. Bu nedenle sekonder spermatositlerin kullanılacağı olgularda, bunlar, nukleusu içinde fazla miktarda metafaz uyarıcı faktörlerin bulunduğu metafaz II oositi içerisine enjekte edilir. Böylece spermatosit nukleusu spontan olarak metafaza girer. Arkasından da oositin elektrik ya da kimyasal yolla artifisyal uyarımı yapıldığında, her iki hücrenin anafaz safhasına geçmeleri sağlanılabilir.
İnsanda aspermatogenezin kültür ortamı içindeki gelişimi değişik çalışmalarda incelenmiştir. Eksperimental olarak da pakiten ve diploten dönemindeki primer spermatositler in vitro koşullarda iki mayoz bölünmeyi tamamlayarak, akrozomu bulunan yuvarlak spermatidleri oluşturabilmektedir. Yuvarlak spermatidlerde 4. saatte %8, 8. saatte ise %22’sinde kuyruk oluşumu görülebilmektedir. Burada, kullanılan kültür ortamının ısısı önemli olup, 32-34oC optimal olarak bulunmuştur. TESE günü ICSI’ye uygun hücre bulunamayan olgularda, doku süspansiyonu 3 gün inkübe edildiğinde, %32’sinde daha ICSI yapılabilecek matüritede germ hücresi geliştiği gözlenmiştir.
Testis doku biyopsileri, 30oC’da, 24-48 saat süreyle, içerisinde 25mIU/ml rekombinan FSH bulunan ortamda bekletildiğinde, nukleusta kondensasyonun tamamlandığı ve nuklear protrüzyon ile flagellum geliştiği izlenmiştir. Kültür ortamında Sertoli hücrelerinin de bulunmasının germ hücrelerinin canlılığının korunmasında gerekli olduğu bildirilmektedir. FSH’nın mayoz ile birlikte erken ve geç spermatogenezi Sertoli hücreleri aracılığı ile uyardığı düşünülmektedir.
Sperm hücrelerinin in vitro koşullarda bekletilmesi, günümüzde TESE olgularında tercih edilen bir uygulama olarak görülmektedir. Özellikle gereksiz OPU yapılmasının önüne geçmek amacıyla, OPU yapılmadan kaç gün önce TESE yapılmasının uygun olacağı konusunda çalışmalar devam etmektedir. Obstrüktif azoospermi olgularında daha belirgin olmak üzere, azoospermi olgularında spermatozoaların 72 saatlik özel kültür ortamında bekletilmeleri sonucu motilitelerinin anlamlı ölçüde artacağı önerilmektedir. Bazı merkezlerde spermin 16-24 saat ya da 6-8 saat bekletildikten sonra ICSI’de kullanılmaları rutin olarak uygulanmaktadır.
Sonuç olarak, TESE olgularında testis dokusunun belirli bir müddet kültür ortamında bekletilmelerinin ICSI sonuçlarını olumlu etkileyeceği düşünülerek, bu konuda çalışmalar sürdürülmektedir.
Benzer şekilde, ICSI için kadının gereksiz yere hazırlanmasını önlemek ve gereksiz masraftan kaçınmak amacıyla, önceden TESE yapılabilir ve eğer uygun spermatozoa bulunursa, ileride kullanılmak üzere dondurularak saklanılabilir. Bu yöntemle elde edilen gebelik oranları, taze sperm kullanılarak elde edilen gebelik oranlarından farklı değildir.
ICSI yapılabilmesi için canlı sperme ihtiyaç vardır. Azoospermi olgularında ya da semende sadece cansız spermin bulunduğu olgularda, girişimsel yollarla sperm elde edilmesi düşünülebilir. Bu yol gerek obstrüktif gerekse nonobstrüktif azoospermili hastalarda uygulanabilir. Günümüzde bu amaçla hem perkütan hem de açık teknikler kullanılmaktadır.
Obstrüktif azoospermili hastalarda duktal sistemden (epididim, duktus deferens) ya da testis parankiminden (TESE) sperm elde edilebilir. Oysa nonobstrüktif azoospermili hastalarda spermin elde edilebildiği tek kaynak testislerdir.
Mikrocerrahi ile epididimlerden sperm aspirasyonu (MESA) genellikle CBAVD gibi obstrüktif azoospermili olgularda duktal sistemdeki spermin toplanmasında kullanılır. Mikrocerrahi becerisi gerektirmediği için bazıları, daha az invaziv olan perkütan yolla epididimlerden sperm aspirasyonunu (PESA) önermişlerdir.
Obstrüksiyonu bulunan hastalar için açık ve perkütan sperm elde etme tekniklerinin gebelik oranları hemen hemen birbirine benzer, ama PESA’ya göre MESA ile çok daha fazla sperm elde edinilebilinir. Fazla sperm dondurularak saklanabildiği ve böylece daha sonraki IVF sikluslarında kullanılabildiği için, hastalarda sadece bir MESA uygulamasına gereksinim duyulur. Oysa PESA’nın, takip eden sikluslarda çok sayıda yapılması gerekebilir. Dondurulmuş ya da taze epididimal spermler kullanılarak yapılmış ICSI olgularından elde edilen gebelik oranları arasında belirgin bir fark bulunmaz.
Obstrüktif azoospermi olgularında sperm elde etmek için kullanılan diğer teknikler seminal vezikül aspirasyonu ve vazal aspirasyondur. Ancak bu tekniklerin kullanımı, distal obstrüksiyonu ya da anejakulasyonu bulunan hastalarla sınırlıdır.
Nonobstrüktif azoosperminin yanı sıra obstrüktif olgularda da testislerden sperm elde etme teknikleri uygulanabilir. Obstrüktif azoospermide hangi teknikle sperm elde edilmiş olursa olsun, gebelik oranları arasında anlamlı bir fark yoktur ve tekniklerin hepsi ile de genellikle sperm elde edilebilmektedir. Ama perkütan tekniğe göre açık teknik ile daha fazla sperm elde etme eğilimi vardır. Ayrıca, nonobstrüktif azoospermi bulunan hastalarda perkütan teknik ile karşılaştırıldığında açık cerrahi yolla olguların daha büyük yüzdesinde sperm elde edilebilmekte ve elde edilen sperm sayısı da daha fazla olmaktadır.
Açık cerrahi ile testislerden sperm elde etme sırasında daha geniş olan seminifer tubüllerin ayırt edilebilmesi için optik büyütme kullanılan olgularda, sperm elde edilen hasta yüzdesinde %45’den %63’e kadar bir artış olduğu bildirilmiştir. Genel olarak, nonobstrüktif azoospermili hastalar için açık cerrahi ile testiküler sperm elde edilmesi önerilmektedir. Obstrüktif azoospermi olgularında ise, açık ya da perkütan teknikler kullanılabilir.
Hiç spermatozoa bulunamayan nonobstrüktif azoospermi olgularına yuvarlak (round) ve uzamış (elongated) spermatidlerin kullanılması denenmiştir. Uzamış spermatidler ile çok sayıda merkezde başarılı sonuçlar alınmasına rağmen, yuvarlak spermatid kullanımının fizibilitesi ve elde edilen gebelik oranları oldukça tartışmalı kalmıştır. Her ne kadar bu teknoloji infertil erkeklerin tedavisinde büyük bir üstünlük sağlamaktaysa da, bu tekniklerin kısmen yeni oldukları ve uzun-dönem güvenilirliklerinin henüz belirlenmediği de akılda tutulmalıdır.
ICSI sikluslarından doğan çocuklarda seks kromozom anomalilerinde artış olduğunu gösteren kanıtlar vardır. ICSI sonrası doğan çocuklarda major konjenital malformasyon oranlarında artış ve zihin (cognitive) gelişiminde azalma olduğundan şüphelendiren diğer kanıtlar oldukça tartışmalıdır. Bu tekniklerin rollerinin yeri ve infertil çifte gerektiği şekilde danışmanlık verilecek olası risklerinin hekim tarafından anlaşılmış olması son derece önemlidir.
Genel olarak değerlendirildiğinde ÜYT, erkek faktörü infertilite olgularının tedavisinde son derece önemli bir yere sahiptir. Ancak, öncelikle infertilitenin nedeni ortaya konulmalı ve düzeltilebilecek bir patolojinin varlığı araştırılmalıdır. ÜYT en son çare olarak düşünülmelidir. Özellikle ICSI’de, olgunun özelliğine göre çiftlerde genetik bilgilendirmenin yapılmasına da dikkat edilmelidir.
KAYNAKLAR
Aydos K: TESE, MESA, PESA, Vazal sperm aspirasyonu. Klinik Androloji. Özdiler E, Aydos K (ed), 682-708, AÜ Basımevi, Ankara, 2000.
Aydos K: İn vitro sperm maturasyonu. Klinik Androloji. Özdiler E, Aydos K (ed), 709-725, AÜ Basımevi, Ankara, 2000.
Malter H: Assisted fertilization. Current Topics in Andrology, Matson P (ed), 121-142, Ladybrook Publishing, West Leederville, Australia, 2003.
Schlegel PN: Sperm retrieval for assisted reproduction. Impotence and Infertility, Atlas of Urol Clin North Am, Vaughan ED, Perlmutter AP (eds), Bölüm 14, Current Medicine Inc, Philadelphia, USA, 1999.
Stanger JD: Sperm preparation. Current Topics in Andrology, Matson P (ed), 105-120, Ladybrook Publishing, West Leederville, Australia, 2003.
World Health Organization. WHO Laboratory Manual for the Examination of Human Semen and Sperm-Cervical Mucus Interaction 1999; Cambridge University Press, Cambridge.
