Prof.Dr. Kaan AYDOS
Spermin genetik yapısındaki bozulma ile infertilite arasında kuvvetli bir birliktelik görülmektedir. Sperm DNA hasarlarının infertilitedeki önemi çok sayıda in vitro ve in vivo çalışmada gösterilmiştir. DNA hasarlı spermatozoa oranı arttıkça (>%30-40) doğal yolla gebe kalma şansı da azalmaktadır (1,2). Kötü kalitedeki sperm DNA’sının fertilizasyonu bozabileceği in vitro çalışmalarda da ortaya konmuştur. Gerçekten de, in vitro fertilizasyon (IVF) uygulanan hastalarda >%4 spermatozoa hasarlı genetik yapıya sahipse fertilizasyon oranları %58’den %38’e düşmektedir (p<0.05) (3). İntrasitoplazmik sperm enjeksiyonu (ICSI) döneminde bu verilerin önemi, hasarlı DNA’nın fertilizasyonu önlemeyeceği ve neticede bu genetik materyali taşıyan embriyoların oluşabileceğinin vurgulanmış olmasıdır (4,5). Dolayısıyla, ejakulatta DNA hasarlı spermatozoa oranının bilinmesi gerek fertilizasyon şansının tahmin edilmesinde gerekse embriyonun maruz kalabileceği risklerin belirlenmesinde önem kazanmaktadır.
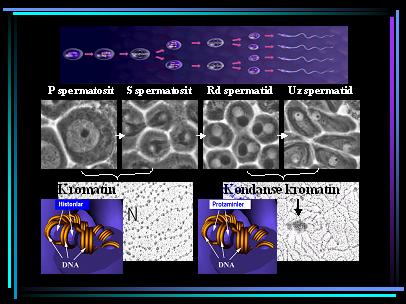
Spermiyogenezde histon/protamin değişiminin kromatin yapılanmasında önemi
Memelilerde spermiyogenez 3 önemli olay ile karakterizedir: 1) akrozom gelişimi; 2) keratin kılıf içine yerleşmiş, dinamik bir aksonemden oluşan kuyruğun organizasyonu; 3) nukleusun kondensasyonu ve uzaması ile birlikte, etrafının mikrotubuler/keratin yapısında bir kılıf ile çevrelenmesi. Erkek gametinde nukleusun kondensasyonu özellikle son 40 yıl içerisinde dikkat çekmiştir. Burada etken olan faktör, spermatogenik seri hücrelerinin kromatin yapısında diğer somatik hücrelerden farklı bazı olayların geliştiğinin ultrastrüktürel düzeyde ortaya çıkarılmış olmasıdır.
Spermiyogenezin başlangıcında haploid spermatidler tipik bir nukleozomal kromatin yapısı gösterirler. Bu evredeyken bol miktarda nonribozomal RNA transkripsiyon aktiviteleri vardır. Ancak, spermiyogenez ilerledikçe boncuk dizilimi şeklinde görünüm veren (klasik nukleozom yapısı nedeniyle) kromatin yapısı yerini düz kromatin liflerine bırakır. Bunlar artık transkripsiyon yapmazlar ve yan yana iplikçikler tarzında toplanırlar (6). Spermatogenez ve spermiyogenez sırasında kromozomal proteinler üzerinde yapılan çalışmalar, spermatosit ve erken evre spermatid kromatinleri üzerinde somatik histonların ve testise spesifik TH1 ve TH2B histonların bulunduğunu, oysa ileri evre spermatidlerde TP1 ve TP2 geçiş (transition) proteinlerinin, daha ileride ise artık protamin P1 ve P2 proteinlerinin yer aldığını göstermiştir. Gerçekten de, ratlarda spermatogenezin 12. ve 16. basamakları arasında nukleusta TP1 ve TP2 proteinleri bulunurken, 16. basamaktan sonra P1 ve P2 proteinleri ortaya çıkmaktadır (7).
Spermde, somatik hücrelerde bulunan histonların daha dayanıklı protaminlerle yer değiştirmeden önce, yukarıda tanımlanan testise spesifik histonlar ve geçiş proteinleri TP1 ve TP2’ye neden ihtiyaç duyulduğu henüz tam izah edilmiş değildir. Gerçektende, eksperimental çalışmalarda TH1 gen ekspresyonu önlendiğinde fertilitenin devam ettiği gösterilmiştir (8). Oysa, her ne kadar TP1 gen delesyonu varlığında komplet spermatogenez tamamlanabilmekteyse de, TP2 ve P2 prekürsörlerinin ortamdaki miktarları artmakta ve matür P2 gelişmeyerek kromatin kondensasyonu olamamaktadır (9). TP1 eksikliğinde sperm motilitesi bozulur ve fertilizasyon kapasiteleri azalır. Bu sonuçlar da ortaya koymaktadır ki; TH1 ve TP1 proteinlerinin kromatin kondensasyonunda ve genin inaktivasyonunda rolleri kısıtlıdır. Aslında geçiş proteinlerinin spermiyogenezde önemleri büyüktür. Yapılan çalışmalar TP1 ve TP2 geçiş proteinlerinin DNA’nın bütünlüğünü koruyarak, protaminlerin kromatin üzerinde daha sağlam yerleşmelerini sağladığını ortaya çıkarmıştır. TP2 geninin regülatör bölümü spermatidlerde CAT (chloramphenicol acetyltransferase reporter) genini etkileyerek mRNA translasyonunu geçici olarak 6 gün geciktirir (10). Bu süreç içerisinde konfigürasyonundaki değişiklikler nedeniyle kromatinin dış faktörlere hassasiyeti artar. Oysa, transkripsiyondaki bu duraklama sayesinde, DNA’da meydana gelebilecek hasarlara da izin verilmemiş olmaktadır.
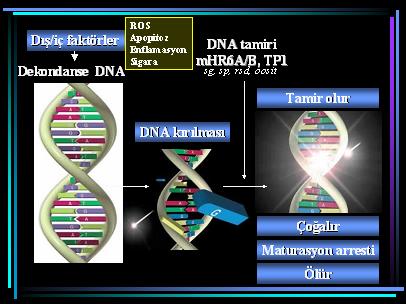
Diğer yandan, TP1’in de DNA kırıklarında tamir edici rolü bulunduğu gösterilmiştir (11). Normal spermiyogenezde spermatidlerde histonların uzaklaştırılması sırasında, bir endonukleaz olan topoizomeraz-II, DNA iplikçiklerinden birini keserek aradan bir parçayı çıkarır. TP1 bu araya girer ve DNA’nın fosfat gruplarıyla etkileşerek açıklığı doldurur. Bu sırada bir DNA ligaz enzimi de TP1’in iki ucunun orijinal DNA iplikçiğine bağlanmasını sağlar. Daha sonra ortama gelen protaminlerde TP1 üzerine tutunurlar. Yan yana gelen kromatinler üzerindeki protaminler arasında disülfid bağları oluşarak, kromatin iplikçiklerinin birbirlerine yaklaşmasını ve neticede kondensasyonu gerçekleştirirler. İşte bu mekanizma, TP1 eksikliğinde neden kromatin kondensasyonunun bozulduğunu izah etmektedir. Bütün bu gözlemler, geçiş proteinlerinden TP1’in DNA tamirinde esas rolü bulunduğuna işaret etmektedir.
Gerek yukarıda açıklandığı şekilde fizyolojik şartlarda ortaya çıkan DNA kırıklarının tamir mekanizmasındaki yetersizlik durumlarında, gerekse patolojik durumlarda meydana gelen DNA hasarlarındaki artış fertilizasyon üzerinde anlamlı derecede olumsuz bir etkiye sahiptir.
DNA hasarlarının klinik önemi
Zini; denatüre ve fragmante DNA taşıyan spermatozoa oranlarının sperm parametrelerindeki bozulma ile anlamlı bir ilişki gösterdiğini, infertil erkeklerde (sırasıyla %25 ve %27) fertillere göre (sırasıyla %10 ve %13) daha yüksek bulunduğunu (p=0.028 ve p=0.016) bildirmektedir (12). Elde edilen sonuçlar, fertilite potansiyelinin belirlenmesinde sperm DNA’sının sağlamlılığının değerlendirilmesinin standart sperm analizi sonuçlarından daha anlamlı olduğunu düşündürmektedir. Gerçekten de, izah edilemeyen infertilite olguları ile karşılaştırıldığında normospermik fertil erkelerin spermlerinde DNA hasarı bulunma oranları anlamlı ölçüde artmaktadır (13). Veriler, tubal obstrüksiyon gibi kadın faktörü bulunan infertilite olgularında erkeklerin de önemli bir kısmında DNA hasarlı sperm oranının yüksek olduğunu ortaya koymuştur (3). Bu sonuçlar, şiddetli kadın faktörü olgularında aslında erkeğe ait faktörlerin de eşlik edebileceğini göstermesi bakımından önemlidir.
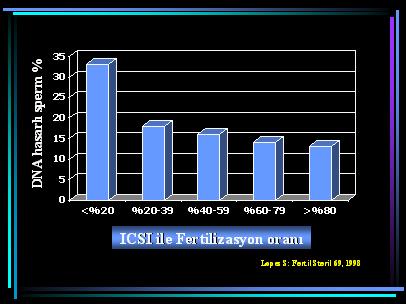
IVF programına alınan erkelerde de semen parametreleri ile DNA integritesi arasında negatif korelasyon bulunmaktadır (14). Dolayısıyla, ICSI’nin özellikle kötü kalitede sperm değerleri bulunan erkeklerde önerildiği dikkate alınırsa, bunlarda DNA hasarlı spermatozoanın oosite enjekte edilme riski de artacaktır. Lopes, DNA hasar sıklığı ile ICSI sonrası fertilizasyon oranları arasında anlamlı ölçüde negatif bir ilişkinin varlığına dikkat çekmiştir (4). Fertilizasyon oranı %20’nin altında kalan olguların %75’inde spermleri ileri derecede (>%25) DNA kırığı içermekteyken, fertilizasyon arttıkça (>%80) hasarlı sperm taşıyan olgu sayısı da azalmaktadır (%0). İlginç olarak, ICSI sırasında normal morfolojide sperm seçilmiş olsa bile fertilizasyon oranları düşük kalmaktadır. Yine de bu konuda henüz bilgilerimiz kısıtlıdır. Aksine bulgular da mevcut olup, yüksek oranda DNA hasarlı sperm içeren semen örnekleri kullanılarak yapılan ICSI olgularında eğer morfolojisi normal spermatozoa enjekte edilmişse, fertilizasyon ve gebelik oranlarının DNA hasarlı sperm oranları ile ilişkili olmadığı da önerilmiştir (3).
Spermde DNA hasarlarının hangi nedenlere bağlı olarak ortaya çıktığı konusu tam olarak izah edilmiş değildir. Değişik çalışmalarda inflamasyon, apopitoz, sigara ve oksidanların (serbest oksijen türevleri, ROS) spermde kromatinin kondanse hale geçmesini engelledikleri gösterilmiştir (14). Kromatinde yeterli kondensasyon gelişmez ise sperm DNA’sı da kırık gelişmesine daha hassas hale gelmektedir (15). DNA hasarı geçiren sperm sonuçta 1) tamir olabilir; 2) tamir kapasitesini aşmış ise hasarlı olarak çoğalmasına devam edebilir; 3) spermatogenez bir seviyede duraklayabilir (maturasyon duraklaması); ya da 4) hücre ölür.
Apopitozis, yani programlı hücre ölümünün de DNA hasarlanması ile ilişkisi gösterilmiştir (16). Aslında apopitoz, vücutta bulunan bütün dokuların normal fonksiyon görebilmesinde önemli bir rol oynar. Spermatozoa için de aynı şey söz konusudur. İnfertilite nedeni olarak bilinen çoğu faktör, spesifik mekanizmalarla apopitoza yol açar. Apopitoz ise DNA’nın parçalanması ile gerçekleşir. Apopitoz organların sağlıklı fonksiyon görebilmeleri için doğal olarak meydana gelebildiği gibi, hormonal faktörler, ROS, çevresel toksinler gibi faktörler tarafından da uyarılabilmektedir.
Testislerde spermatozoa yapımı ve maturasyonu Sertoli hücrelerinin desteği altında gerçekleşir. Ancak bu olayın sağlıklı sürebilmesi, Sertoli hücrelerinin sayısı ile spermatogonia sayısı arasındaki belirli orana bağlıdır. Çünkü zaten çoğalma kapasitesi olmayan Sertoli hücreleri sadece belirli sayıdaki spermatogoniumları destekleyebilir. Yani, mayoz bölünmeye girecek spermatogonium sayısı sınırlıdır. Eğer spermatogonia sayısı, Sertoli hücrelerinin destek kapasitesini aşarsa, fazla hücreler apopitoz ile parçalanır (3).
Eksperimental çalışmalarda germ hücrelerinin apopitozunda testosteronun da etkili olduğu bildirilmiştir (17). Spermatogenez sırasında apopitozun başlatılmasında etken bir başka faktör ise germ hücreleri ve lökositlerden kaynaklanan ROS yapımı ve miktarı ile ilişkilidir (16,18). İnsan spermi ile yapılan çok sayıdaki çalışmada hücre ölümü ile ROS üretimi arasında sıkı ilişki bulunduğu vurgulanmıştır (19,20). İnflamasyon hücreleri salgıladıkları sitokinler ile apopitozu başlatabilir (21).
DNA hasarlı sperm kullanılarak başarılan fertilizasyonun uzun süreli klinik sonuçları bilinmemektedir. İnfertil erkeklerde DNA hasarlı spermatozoa oranlarının anlamlı ölçüde artması, bunlarda sıklıkla üremeye yardımcı teknikler (ÜYT) kullanılarak doğal bariyerler atlandığı için, oldukça önem kazanmaktadır. Gerçekten de, doğal yolla gerçekleştiği zaman, fallop tüplerine tutunan spermatozoalar tutunmayanlara göre daha fazla oranda sağlam DNA’ya sahip bulunmaktadırlar (22). Buda in vivo fertilizasyon sırasında doğal olarak DNA’sı sağlam spermin seçildiğini göstermektedir.
Oysa IVF/ICSI sırasında sperm seçimi randomize yapıldığı için ve özellikle semen değerleri bozuk olan erkeklerde hasarlı genetik materyal taşıyan hücre sıklığı da artmış olacağından, bunlarda DNA hasarlı hücre kullanma riski de ortaya çıkmaktadır. Ancak unutulmamalıdır ki, DNA üzerinde yapılan testlerden elde edilen sonuçlar fertilizasyon ve sonrası olaylar hakkında sadece tahmini fikir vermektedir. Çünkü, her ne kadar laboratuvar çalışmalarında güvenilirliliği yüksek testler kullanılarak bu hasarlar gösterilebilse de, fiksasyon, denatürasyon ve boyama işlemleri sırasında hücrede kalıcı dejenerasyon oluşturduklarından, IVF/ICSI’de kullanılmak üzere seçilen spermde bunu göstermek mümkün olmamaktadır. Dolayısıyla, ÜYT’de kullanılacak semen örneğinin sadece bir kısmında araştırma yapılmakta ve burada saptanan DNA hasar oranı tüm semene yorumlanmaktadır.
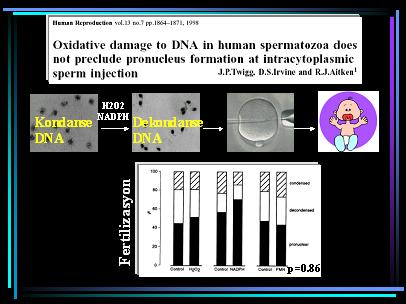
Diğer yandan, sperm DNA kalitesi bozulduğunda IVF oranları düşse bile bu normal fertilizasyonu engellememektedir. DNA hasarı için, altında fertilizasyonun gerçekleşebileceği ama embriyo gelişiminin bozulabileceği bir eşik değerin bulunabileceği önerilmektedir (1,2). Ayrıca, spermatozoanın DNA hasarlarını tamir etme kapasitesine sahip endonukleaz aktivitesi içerdiği de bilinmektedir (23). Ama DNA hasarlı spermin yetersiz ya da yanlış tamiri, de novo genetik mutasyonların gelişmesi ile de sonuçlanabilir (24). Bütün bu sonuçlar infertilite olgularında sperm DNA hasarlarının önemli bir faktör olabileceğini vurgulamaktadır. Defektif genetik materyalin yeni doğana aktarılması olasılığı ise ayrıca önemlidir. Günümüzde erkek faktörü infertilite olgularında sıklıkla önerilen ICSI ile, seçici bir çok bariyer atlanılarak fertilizasyon başarılıyor olmakla birlikte, IVF yapıldığında DNA hasarlarının embriyo gelişimi üzerine olumsuz etkilerinin gözlenmiş olması, böyle hastaların tedavisinde daha başka önlemlerin alınması ve tedavi alternatiflerinin geliştirilmesinin gerekli olduğu kanısını vermektedir.
Konuyla ilgili daha fazla resim için
SPERM DNA HASARLARININ HMG/FSH İLE TEDAVİSİ
KAYNAKLAR
1. Evenson DP, Jost LK, Marshall D, Zinaman MJ, Clegg E, Purvis K, de Angelis P, Claussen OP. Utility of the sperm chromatin structure assay as a diagnostic and prognostic tool in the human fertility clinic. Hum Reprod 1999;14(4):1039-49.
2. Spano M, Bonde JP, Hjollund HI, Kolstad HA, Cordelli E, Leter G. Sperm chromatin damage impairs human fertility. The Danish First Pregnancy Planner Study Team. Fertil Steril 2000;73(1):43-50.
3. Host E, Lindenberg S, Smidt-Jensen S. The role of DNA strand breaks in human spermatozoa used for IVF and ICSI. Acta Obstet Gynecol Scand 2000l;79(7):559-63.
4. Lopes S, Sun JG, Jurisicova A, Meriano J, Casper RF. Sperm deoxyribonucleic acid fragmentation is increased in poor-quality semen samples and correlates with failed fertilization in intracytoplasmic sperm injection. Fertil Steril 1998;69(3):528-32.
5. Ahmadi A, Ng SC. Fertilizing ability of DNA-damaged spermatozoa. J Exp Zool 1999;284(6):696-704.
6. Kierszenbaum AL, Tres LL. Structural and transcriptional features of the mouse spermatid genome. J Cell Biol 1975;65(2):258-70.
7. Kierszenbaum AL. Transition nuclear proteins during spermiogenesis: unrepaired DNA breaks not allowed. Mol Reprod Dev 2001;58(4):357-8.
8. Fantz DA, Hatfield WR, Horvath G, Kistler MK, Kistler WS. Mice with a targeted disruption of the H1t gene are fertile and undergo normal changes in structural chromosomal proteins during spermiogenesis. Biol Reprod 2001;64(2):425-31.
9. Yu YE, Zhang Y, Unni E, Shirley CR, Deng JM, Russell LD, Weil MM, Behringer RR, Meistrich ML. Abnormal spermatogenesis and reduced fertility in transition nuclear protein 1-deficient mice. Proc Natl Acad Sci U S A 2000;97(9):4683-8.
10. Nayernia K, Bohm D, Topaloglu O, Schluter G, Engel W. Rat transition nuclear protein 2 regulatory region directs haploid expression of reporter gene in male germ cells of transgenic mice. Mol Reprod Dev 2001;58(4):368-75.
11. Caron N, Veilleux S, Boissonneault G. Stimulation of DNA repair by the spermatidal TP1 protein. Mol Reprod Dev 2001;58(4):437-43.
12. Zini A, Bielecki R, Phang D, Zenzes MT. Correlations between two markers of sperm DNA integrity, DNA denaturation and DNA fragmentation, in fertile and infertile men. Fertil Steril 2001;75(4):674-7.
13. Irvine DS, Twigg JP, Gordon EL, Fulton N, Milne PA, Aitken RJ. DNA integrity in human spermatozoa: relationships with semen quality. J Androl 2000;21(1):33-44.
14. Sun JG, Jurisicova A, Casper RF. Detection of deoxyribonucleic acid fragmentation in human sperm: correlation with fertilization in vitro. Biol Reprod 1997;56(3):602-7.
15. Jurisicova A, Lopes S, Meriano J, Oppedisano L, Casper RF, Varmuza S. DNA damage in round spermatids of mice with a targeted disruption of the Pp1cgamma gene and in testicular biopsies of patients with non-obstructive azoospermia. Mol Hum Reprod 1999;5(4):323-30.
16. Vinatier D, Dufour P, Subtil D. Apoptosis: a programmed cell death involved in ovarian and uterine physiology. Eur J Obstet Gynecol Reprod Biol 1996;67(2):85-102.
17. Billig H, Chun SY, Eisenhauer K, Hsueh AJ. Gonadal cell apoptosis: hormone-regulated cell demise. Hum Reprod Update 1996;2(2):103-17.
18. Aitken RJ, Gordon E, Harkiss D, Twigg JP, Milne P, Jennings Z, Irvine DS. Relative impact of oxidative stress on the functional competence and genomic integrity of human spermatozoa. Biol Reprod 1998;59(5):1037-46.
19. de Lamirande E, Gagnon C. Impact of reactive oxygen species on spermatozoa: a balancing act between beneficial and detrimental effects. Hum Reprod 1995;10 Suppl 1:15-21.
20. Shen HM, Chia SE, Ong CN. Evaluation of oxidative DNA damage in human sperm and its association with male infertility. J Androl 1999;20(6):718-23.
21. Higuchi M, Singh S, Chan H, Aggarwal BB. Protease inhibitors differentially regulate tumor necrosis factor-induced apoptosis, nuclear factor-kappa B activation, cytotoxicity, and differentiation. Blood 1995;86(6):2248-56.
22. Ellington JE, Evenson DP, Wright RW Jr, Jones AE, Schneider CS, Hiss GA, Brisbois RS. Higher-quality human sperm in a sample selectively attach to oviduct (fallopian tube) epithelial cells in vitro. Fertil Steril 1999;71(5):924-9.
23. Maione B, Pittoggi C, Achene L, Lorenzini R, Spadafora C. Activation of endogenous nucleases in mature sperm cells upon interaction with exogenous DNA. DNA Cell Biol 1997;16(9):1087-97.
24. Kuchino Y, Mori F, Kasai H, Inoue H, Iwai S, Miura K, Ohtsuka E, Nishimura S. Misreading of DNA templates containing 8-hydroxydeoxyguanosine at the modified base and at adjacent residues. Nature 1987;327(6117):77-9.