HİÇ CANLI SPERMİ OLMAYAN ERKEKLER ÇOCUK SAHİBİ OLABİLİR Mİ?
Tahlillerde ölü ya da canlı hiç sperm görülmeyen azoospermik erkeklerin bir kısmı doğal yolla çocuk sahibi olabilir. Şayet sperm taşıyan kanallarda tıkanıklık varsa bunların cerrahi yolla düzletildiği ya da hipogonadotropik hipogonadizim olarak bilinen hormon eksikliğinin tedavisi ile normal sperm çıkışının sağlandığı erkekler doğal yolla da eşlerini gebe bırakabilir. Geri kalan olguların ise yaklaşık yarısı testislerden alınacak spermlerin tüp bebekte kullanılmasıyla baba olabilir. Hatta önceden sperm üretimini destekleyici hormonal ya da besleyici tedavilerin kullanılması testislerde bozulmuş sperm üretimini düzelterek tüp bebeğin başarısı artırılabilir. Bunların hiçbirinden faydalanamayan erkekler içinse son yıllarda kök hücreye yönelik çalışmalar ilerisi için oldukça umut vericidir.
NEDEN İLERİ YAŞ ERKEKLERDE SPERM KALİTESİ BOZULUR?
Burada en önemli neden, spermlerin içinde yüzdükleri sıvıda yıllar içerisinde biriken zararlı maddelerin yarattığı oksidatif strestir. Sigara, alkol, obezite, iş yerindeki kimyasallar, toksik gazlar, kötü beslenme, cep telefonu ya da bilgisayarlardan yayılan elektromanyetik dalgalar, yılların getirdiği stres gibi çeşitli çevresel faktörler ve düzensiz yaşam tarzı bu yolla sperm sağlığını bozarak DNA hasarında artışa yol açar. DNA hasarındaki artış ister doğal yolla olsun ister tüp bebekle, döllenmeyi ve embriyo gelişimini olumsuz etkiler, düşük riskini artırır. Yaşlanan erkekte kalp, damar ve solunum sistemi başta olmak üzere çeşitli metabolik rahatsızlıkların artışı ile bunların tedavisinde kullanılan ilaçlar da testislerde sperm üretiminde ciddi sorun yaratabilir.
Bütün bunların yanı sıra 40 yaşından sonra aktif testosteron hormonunda düşme başlar. Buna diyabet, hipertansiyon gibi kronik hastalıklar ve psikojenik faktörlerin de eklenmesiyle artan cinsel ilişkiye girmede sıkıntı ya da meni çıkışında azalma ileri yaş erkek kısırlığı için önemli bir risk oluşturmaktadır.
YAŞ İLE SPERM HAREKETLİLİĞİ İLİŞKİSİ
Yaşlanmaya bağlı sperm kalitesindeki bozulmanın en dikkat çeken parametresi sperm hareketindeki azalmadır. Her geçen yıl hareketteki bozulma %1’e yakın düşerek, 20 yılın sonunda %13’e kadar geriler. Oysa bir spermin yumurtaya ulaşabilmesi için güçlü kuyruk hareketine sahip olması gerekir. Normalde spermlerin en az üçte biri ileri doğru hareket edebilmeli. Bunun altında kalması, erkeğin baba olma şansını anlamlı ölçüde azaltır.
ERKEK YAŞI İLE SPERMİN GENETİK KALİTESİ ARASINDAKİ İLİŞKİ
İlerleyen yaşla birlikte kısırlık sıklığındaki artışın başlıca nedenleri yıllar geçtikçe sperm üreten kök hücrelerde biriken genetik bozukluklar ve oksidatif stresin spermlerde yol açtığı DNA hasarındaki artıştır. Nitekim ileri yaş erkeklerin çocuklarında gelişim anomalilerinin sıklığının arttığı bilinmekte. Erkek 45 yaşın üzerindeyse, gebelik kayıpları ve düşük ağırlıklı doğumlar ile erken doğumlar ve doğumsal defektlere daha fazla rastlamaktayız. 40-45 yaş arası erkeklerin 2 ila 3 kat daha fazla otistik ya da psikolojik bozukluklu bebek dünyaya getirdikleri bildirilmiştir.
ERKEKLER HER YAŞTA BABA OLABİLİR Mİ?
Üreme başarısı söz konusu olunca erkekler kadınlardan biraz daha şanslıdır. Çünkü kadının menopoza girmesiyle anne olma şansı kaybolur. Oysa kural olarak bir erkek her yaşta baba olma fırsatını yakalayabilir. Ancak yaşın ilerlemesiyle birlikte erkeğin eşini gebe bırakabilme olasılığı düşmektedir. 40 yaş, erkek için bir uyarıdır. 25 yaşındaki durumuyla kıyaslanınca, 40 yaş üzerindeki erkeklerin baba olmak için 5 kat daha uzun süre beklemek zorunda kaldıkları görülüyor. Populasyon çalışmaları bu yaştan sonraki erkeklerin çocuk sahibi olabilme kapasitelerinin her yıl %23 azaldığını ortaya çıkardı.
İNFERTİL ERKEKLERDE KÖK HÜCRE TEDAVİSİ
İnfertiliteye, evli çiftlerin yaklaşık %10-15’inde rastlanılır. Bunların da yaklaşık %7’sinde azoospermi söz konusudur. Nonobstrüktif azoospermi (NOA)’de sorun, sıklıkla haploid özellikteki spermatid ya da spermatozoa seviyesi hücrelerin sayı ve kalite bozukluğudur. Bunun da temelinde tek gen mutasyonları ya da kromozom defektleri şeklinde genetik faktörler yatar. Ancak yakın tarihli çalışmalar, eğer genetik bir anomali söz konusu değilse, kök hücre tedavisinin erkek faktörü infertilite tedavisinde bir umut olabileceğini vurgulamaktadır1.
NOA olgularının büyük kısmında mikroTESE ile olgun sperm bulunamaz ve neticede immatür sperm serisi hücrelerinin kullanımına ihtiyaç ortaya çıkar. Son yıllarda böyle olguların tedavisinde önemli ilerlemeler kaydedilmiştir. Kök hücre tedavisi bu araştırmalarda önemli bir yer tutar.
Embriyonik Kök Hücre (Embryonic stem cell; ES) Kaynaklı Erkek Germ Serisi Hücreleri
ES hücreler embriyonun blastosist aşamasında oluşan iç embriyo kitlesinden (inner cell mass; ICM) gelişen totipotent hücreler olup, endoderm, ektoderm ve mezoderm gibi üç ana dokuya farklılaşma yeteneği gösterirler. Bunlar arasında germ serisi hücreler de vardır. Embriyonik kök hücre serileri, somatik hücre çekirdek transferi yoluyla yetişkin hücrelerden elde edilebilir. Embriyo içine verildikleri zaman germ serisi yönünde gelişim göstererek normal sperm yapabilirler2. Fare ve insan ES hücreleri kullanılarak germ hücresi elde edilmesi konusunda oldukça ümit verici sonuçlar alınmıştır.
ES uygulamalarında Embriyoid Cisim (embryoid body; EB) kullanımı önemli bir yer tutar. EB, vücuttaki dokuları oluşturmak üzere yönlenmiş, üç germ tabakasından kaynaklanan hücreleri içerir. EB üzerine BMP4 (bone morphogenic protein) kullanılarak stimülasyon yapıldığında farelerde ES hücrelerinin erkek germ serisi hücrelerine farklılaştığı gösterilmiştir3. Burada önce MVH gen markırı ile işaretli ES hücreleri in vitro ortamda inkübe edilmiş ve EB hücreleri oluşturulmuştur. Daha sonra MVH-pozitif hücreler seçilerek BMP4 üreten hücreler ile birlikte muamele edilip fare testisine nakledilirler. Neticede, markır olarak ortama eklenmiş olan MVH taşıyan hücrelerin sperm geliştirdikleri gösterildi. Benzer şekilde retinoik asit (RA) kullanılan çalışmalarda da EB hücreleri seçilerek mayozunu tamamlamış germ serisi hücrelere dönüşebildikleri, hatta oositi fertilize edebildikleri bildirilmiştir4. Bu yöntemle farelerde FE-J1, Dazl, Fragilis, MVH, Akrozin ve asetil alfa tubulin pozitif spermatogonium, spermatosit, spermatid ve olgun sperm benzeri hücre gelişimleri diğer çalışmalarda da başarılmıştır5. 2006 yılında Nayernia ve ark, ilk kez fare ES hücrelerinin in vitro koşullarda haploid spermatidlere dönüştüklerini ve canlı doğumla sonuçlandığını bildirmiştir6. Burada araştırıcılar, fare ES hücrelerini önce Stra8-EGFP geni ile transfekte ettiler ve RA içeren ortamda inkübasyona bıraktılar. Daha sonra Stra8 pozitif hücreler seçilerek Prm1-DsRed geni ile yeniden transfekte edildi ve bu markırı taşıyan hücreler ayrıştırılarak fare testisine enjekte edildi. Histolojik incelemelerde seminifer tubül formasyonu görüldü ve sperm hücrelerine farklılaştığı izlendi. Prm1 pozitif hücreler yumurtaya enjekte edildiğinde ise yavruları dünyaya geldi.
Diğer yandan, 2 basamaklı adherent hücre farklılaşması tekniği ile de fare ES hücrelerinden erkek germ serisi hücreler geliştirilmiştir7. Burada ilk basamakta fare ES hücreleri Active A, bFGF ve KSR (knockout serum replacement) ile uyarılarak epiblast-benzeri hücreler elde edildi ve arkasından BMP4, BMP8b, SCF (stem cell factor), LIF (leukemia inhibitory factor) ve EGF sitokinleri kullanılarak primordial germ hücresi-benzeri (PGCLCs) hücreler geliştirildi. Bunlar da seminifer tubüllerin içine enjekte edildi. Histolojik tetkiklerde spermatogenezin geliştiği izlendi. Oluşan spermatozoa ise yumurtaya enjekte edildiğinde fertilizasyon sağlandı ve normal yavrular dünyaya geldi.
İnsanda ise ES hücrelerinin kendiliğinden EB hücrelere farklılaşmaları ile erkek germ serisi hücreler elde edilmiştir8. İnsan ES hücrelerinden gelişen EB hücreleri VASA, BOL, SCP1 ve SCP3taşıyan, haploid germ serisi hücrelere dönüşebilmektedir. “Adherent cell differentiation” protokolü insanda da uygulanmış ve ES hücrelerinde germ serisi hücreler elde edilebilmiştir. Bunun dışında insan fötal gonad hücreleri ile yapılan co-culture tekniği de ES hücrelerden PGS hücre elde edilmesinde kullanılmıştır9. Ama bunlarda mayoz ötesine bir gelişim gösterilememiştir. Yine de yakın tarihli çalışmalarda insanda herhangi bir genetik manipülasyon yapılmaksızın ES hücrelerinin doğrudan haploid hücre aşamasına gelebilecekleri ortaya konmuştur10. Burada MEM, BSA, insülin, transferrin, putresin, L-glutamin, beta nerkaptoetanol, bFGF, GDNF (glial cell-derived neurotrophic factor), sodyum selenit, linoleik asit, linolenik asit ve HEPES içeren fare SSC kültür ortamında insan ES hücreleri doğrudan mayozunu tamamlamış, spermatid benzeri erkek germ hücre serisine farklılaşmıştır. Ancak bunların fertilizasyon potansiyelleri hakkında bir bilgimiz yok.
Netice olarak, erkek infertilitesinin tedavisinde ES hücrelerinin kullanılmasıyla erkek germ hücresi elde edilmesi ümit verici bir teknik olarak dikkat çekmektedir. Ancak bu hücrelerin genetik yapılarının hasta ile uyum problemi henüz çözülmemiştir. Etik olarak da sorunlar vardır. Özellikle ES hücrelerinin kaynağı burada soru işaretidir.
Uyarılmış Pluripotent Kök Hücre (Induced pluripotent stem cell; iPS) Kaynaklı Erkek Germ Hücre Eldesi
EB’nın yanı sıra, iPS hücreler kullanılarak da haploid aşamasında germ serisine erişilebilmiştir11. Bu hücreler transkripsiyon faktörleri ile somatik hücrelerin yeniden programlanması yoluyla elde edilmekte olup, pluripotansiyel kapasite taşıdıkları için programlandıkları yönde farklılaşma gösterirler. Germ hücre elde etmek amacıyla yapılan iPS tekniğinde, vücudun somatik hücrelerinden, Oct3/4, Sox2, Klf4, c-Myc, Lin28 ve Nanog gibi transkripsiyon faktörlerinden faydalanılarak iPS hücrelerinin elde edilmesine çalışılır12. iPS hücrelerin bazı avantajları vardır. En başta bunların kullanımı etik bakımdan bir sorun oluşturmaz. Ayrıca, iPS hücrelerin elde edilebileceği kaynak çok geniştir. Bunun dışında, hastanın kendinden alınmaları nedeniyle genetik yapısı hakkında bilgimiz de olur. Bu hücreler hastanın kendi somatik hücrelerinde elde edilebildiği için hastaya özgü çok sayıda hücre elde etmek mümkün olabilir.
Son yıllarda, fötal ve erişkin somatik hücrelerin yeniden programlanmasını takiben iPS hücrelerinden PGS hücreler elde edilebileceği yönünde çok sayıda çalışma bildirilmiştir. iPS hücrelerinin BMP4 eklenen ortamda epiblast benzeri hücrelere dönüşebileceği ve bunlardan da primordial germ hücrelerinin elde edilebileceği hatta yavru dünyaya gelebileceği gösterildi13. Araştırıcılar her ne kadar bu tekniği tekrarladıklarında benzer sonuçlar elde etmiş olsalar da, bazı hayvanlarda tümör gelişmesi, daha fazla araştırma yapılması gereğini ortaya koymakta. Daha yeni çalışmalarda insanda iPS hücrelerinin, insan fötal gonadal stromal hücreleri ile kültüre edilmeleri durumunda PGC benzeri hücrelere farklılaştıkları ortaya konmuştur9. İnsanda iPS hücrelerinin PGC hücrelerine farklılaşmasında BMP’nin etkili olabileceği gösterilmiştir14.
Bu tekniğin temelinde, gen ekspresyonu manipüle edilerek iPS hücrelerinin istenilen hücre hattına farklılaşmalarının belirlenmesi vardır. VASA ve DAZL gibi RNA’ya bağlanan proteinlerin insanda iPS hücrelerinden gelişen germ serisi hücrelerin mayoza girme potansiyellerini in vitro şartlarda artırdığı anlaşılmıştır. Diğer yandan, RA kullanılarak 3 hafta içerisinde insan ES hücrelerinden haploid karakterde iPS hücreleri de oluşturulabilmiştir10. Ayrıca, Forskolin, insan rekombinan LIF, bFGF ve CYP26 inhibitör R115866 içeren kültür ortamında insan iPS hücrelerinin, spermatogonium, premayotik spermatosit, postmayotik spermatosit ve yuvarlak spermatid markırlarını gösteren daha ileri erkek germ hücre serilerine farklılaşmaları da sağlanmıştır10. Ancak, iPS hücrelerden elde edilen yuvarlak spermatidlerin oositi fertilize etme ve embriyo oluşturma kapasiteleri hakkında bir fikrimiz henüz bulunmamakta. Yine de insanda iPS hücrelerinden elde edilen germ hücrelerinin genetik instabiliteleri ve tümör oluşturma riskleri bunların klinik uygulanımlarını kısıtlamaktadır.
Spermatogonial Kök Hücre (Spermatogonial stem cell; SSCs)
Spermatogonial kök hücrelerin en önemli özelliği, genetik malzemeyi sonraki kuşaklara taşıyan tek hücre grubu olmasıdır. Bunlar, Sertoli hücreleri, ekstrasellüler matriks ve peritubüler miyoid hücre desteği altında kendi kendilerine çoğalabilme potansiyeline sahip hücrelerdir. Yakın tarihli çalışmalarda testis dokusu laboratuvar ortamında inkübe edildikten sonra yeniden testise nakledildiğinde, ratlarda spermatogenezin sürdürülebileceği de gösterildi15.
Bu anlamda, in vitro ortamda spermatositlerden mayozunu tamamlamış spermatidler elde edilebilmiştir. Gerçekten de sıçan testis hücre süspansiyonu 4 gün inkübe edildiğinde spermatosit ve arkasından da spermatide dönüşebildiği, morfolojik ve biyokimyasal olarak gösterilmiştir16. Farelerde de spermatogoniumlar izole edilip TERT ile işlem gördükten sonra SCF ortamında yuvarlak spermatidlere kadar farklılaşabilmektedir. Ancak burada sorun, spermatogoniumlardan gelişen spermatidlerin fonksiyonel yönden sonuç verip vermeyecekleridir. Yakın tarihte in vitro şartlarda seminifer tubüller içerisinde haploid hücreleri besleyebilecek bir mikro çevre ya da niş oluşturmak amacıyla 3D hücre kültür sistemleri düzenlenmesi üzerinde çalışmalar başlamıştır17. Gerçekten de, 7 günlük immatür farelerin testislerinden alınan hücreler 3D soft agar ortamında bekletildiklerinde postmayotik, morfolojik olarak olgun hücrelere benzeyen spermler elde edilebildi ve diğer çalışmalarda da onaylandı18. Eğer kanser tedavisi öncesi testis dokusu saklanıyorsa, bunların transplantasyonunu takiben malinitenin de taşınma olasılığına karşın, FACS (fluorescence activated cell sorter) ve markır taramaları yapılarak bu riskin elimine edilmesi önemlidir.
Daha yakın çalışmalarda ise spermatogenezi baştan sona destekleyebilen yeni bir organ kültür sistemi geliştirilerek, yeni doğan fare testis dokusunda serumsuz besiyerinde spermatid seviyesine kadar geliştirilmiş ve ROSI/ICSI ile başarılı fertilizasyon denemeleri yapılmış, hatta yavru doğurtulabilmiştir15. İnsan spermatogoial kök hücrelerinin (SSCs) laboratuvar şartlarında olgunlaştırılarak, oositi fertilize edebilecekleri, ancak son yıllarda gösterildi25. İnmemiş testisli bir grup erkekte testislerden alınan spermatogoniumlar, retinoik asit ve SCF (stem cell factor) içeren ortamda inkübe edildiğinde, mayoz bölünmeyi tamamlamış spermatidlere kadar gelişim sağlandı. Mayozun tamamlandığı, kültür ortamında SCP3-, MLH1-, and CREST pozitif hücre artışı ile ortaya konuldu. Bu hücreler fare oositleri içerisine enjekte edildiğinde, 2 hücreli embriyo aşamasına gelindiği görüldü. In vivo şartlarda SSCs’lerin fertilizasyon kapasite kazanmış olmaları, NOA’li hastaların ileriye yönelik tedavi umutlarını artırmaktadır. Erken evre germ hücrelerinin kullanılması ile insanda klinik olarak gebelik sağlanan tedavilere en son örnek, sperm FISH boyaması ile haploid karakterde oldukları belirlenen spermatidlerin kullanıldığı ROSI uygulanması ile sağlıklı çocukların dünyaya gelmiş olmasıdır. Gerçekten de bu yolla 14 sağlıklı doğum olgusu bildirilmiştir26. Her ne olursa olsun, bu güne kadar SSC hücrelerinin in vitro şartlarda olgun erkek germ hücrelerine farklılaşmaları konusu yüksek bir etkinliğe ve pratik uygulama kolaylığına erişememiştir.
In vitro şartlarda ve 3D kültür ortamında SSC hücrelerinin desteklenmesinin yanı sıra, SSC hücrelerinin ya da testis hücrelerinin transplantasyonu ile in vivo koşullarda germ hücre gelişiminin sağlanması daha başarılı bir klinik uygulama alanı bulmuştur19. Bu uygulamada asıl sorun ise saf spermatogonium elde edebilmektir. Genelde saf spermatogonium tip A elde oranları, değişik teknik ve çalışma şartları göz önüne alındığında %0.3 ile %30 arasında kalmaktadır.
SSC transplanatasyonu yerine testis dokusunun ya da kültür ortamında işlem görmüş doku örneklerinin nakli daha umut verici olabilir. Çünkü bu şekilde, sperm hücrelerinin içinde geliştiği destek hücreleri de kullanılabilir. Yenidoğan fare, domuz ve keçilerden elde edilen testis doku örnekleri deri altına nakledildiklerinde spermatogenez tamamlanabilmekte ve hatta sağlıklı yavrular dünyaya gelebilmektedir20. Ancak erişkin testis doku graftları daha az gelişim göstermekteler. Bu konuda daha fazla araştırmaya ihtiyaç var.
Acaba insanda testis dokusu diğer tür hayvanların testisine nakledilse, benzer spermatogenez aşamaları sağlanabilir mi sorusu üzerine yapılan fare çalışmalarında haploid hücre serilerine kadar ilerleme sağlanabilmişti. Bu şekilde, prepubertal erkek testis dokularının ksenograft nakilleri 4-12 ay süreyle spermatogenezin devam edebileceği yönündedir21. Ancak bunlarda sadece spermatosit evresine kadar gelinebildiği de bilinmelidir. Ayrıca, erişkin insan testis dokuları bu yöntemle fare testisine nakledildiğinde, sonuçlar iç açıcı olmamakta. Dolayısıyla, otolog transplantasyon daha umut verici olmakta.
Diğer yandan, nonobstrüktif azoospermisi bulunan erkeklerde testis biyopsisi ile alınan doku örnekleri, içinde FSH ya da FSH ve Testosteron bulunan Vero hücre kültürü içinde bekletilmeleri durumunda geç evre spermatid elde edilebilmiştir22. Benzer şekilde, azoospermik hastalarda testis dokusundan CD49f pozitif hücreler izole edilerek, in vivo ortamda benzer şekilde Sertoli hücreleri ile kültüre edilmiş ve haploid hücreler gelişmektedir23.
Spermatogonium kök hücre popülasyonunun günümüzde önemli bir uygulama alanı, kemoterapi ya da radyoterapi öncesi fertilitenin korunmasıdır. Değişik nedenlere bağlı kanser olgularında erkeklerde en büyük sorun, tedavinin testislerde sperm üretimini bozmasıdır. Genç yaşta tedavi almak zorunda kalan hastalarda primer hastalık tamamen iyileşse bile, ileride azoospermi gelişmesi bunların doğal yolla çocuk sahibi olmalarını engeller. Gerçekten de kemoterapi ya da radyoterapi hastaların %80’inde sperm üretimini tamamen ortadan kaldırmakta. Her ne kadar büyük kısmı 4 yıl içinde az da olsa sperm yapmaya başlasa da, geri kalanlarında sorun devam edebilir. Yakın tarihte bir grup araştırıcı hayvanlarda yaptıkları bir çalışmada bu konuda umut veren önemli sonuçlar elde ettiler24.
Kaynaklar
- Hou J, Yang S, Yang H, Liu Y, Liu Y, Hai Y, et al. Generation of male differentiated germ cells from various types of stem cells. Reproduction. 2014;147(6):R179-R188.
- Bradley A, Evans M, Kaufman MH, Robertson E. Formation of germ-line chimaeras from embryo-derived teratocarcinoma cell lines. Nature. 1984;309(5965):255-6.
- Toyooka Y, Tsunekawa N, Akasu R, Noce T. Embryonic stem cells can form germ cells in vitro. Proc Natl Acad Sci U S A. 2003;100(20):11457-62.
- West JA, Park IH, Daley GQ, Geijsen N. In vitro generation of germ cells from murine embryonic stem cells. Nat Protoc. 2006;1(4):2026-36.
- Kerkis A, Fonseca SA, Serafim RC, Lavagnolli TM, Abdelmassih S, Abdelmassih R, Kerkis I. In vitro differentiation of male mouse embryonic stem cells into both presumptive sperm cells and oocytes. Cloning Stem Cells. 2007;9(4):535-48.
- Nayernia K, Nolte J, Michelmann HW, Lee JH, Rathsack K, Drusenheimer N, et al. In vitro-differentiated embryonic stem cells give rise to male gametes that can generate offspring mice. Dev Cell. 2006;11(1):125-32.
- Hayashi K, Ohta H, Kurimoto K, Aramaki S, Saitou M. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell. 2011;146(4):519-32.
- Clark AT, Bodnar MS, Fox M, Rodriquez RT, Abeyta MJ, Firpo MT, Pera RA. Spontaneous differentiation of germ cells from human embryonic stem cells in vitro. Hum Mol Genet. 2004;13(7):727-39.
- Park TS, Galic Z, Conway AE, Lindgren A, van Handel BJ, Magnusson M, et al. Derivation of primordial germ cells from human embryonic and induced pluripotent stem cells is significantly improved by coculture with human fetal gonadal cells. Stem Cells. 2009;27(4):783-95.
- Eguizabal C, Montserrat N, Vassena R, Barragan M, Garreta E, Garcia-Quevedo L, et al. Complete meiosis from human induced pluripotent stem cells. Stem Cells. 2011;29(8):1186-95.
- Takahashi K, Yamanaka S. Induction of pluripotent stem cells from Mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006;126(4):663-76.
- Okita K, Ichisaka T, Yamanaka S. Generation of germline-competent induced pluripotent stem cells. Nature. 2007;448(7151):313-7.
- Hayashi K, Ohta H, Kurimoto K, Aramaki S, Saitou M. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell. 2011;146(4):519-32.
- Panula S, Medrano JV, Kee K, Bergström R, Nguyen HN, Byers B, et al Human germ cell differentiation from fetal- and adult-derived induced pluripotent stem cells. Hum Mol Genet. 2011;20(4):752-62.
- Sato T, Katagiri K, Yokonishi T, Kubota Y, Inoue K, Ogonuki N, et al. In vitro production of fertile sperm from murine spermatogonial stem cell lines. Nat Commun. 2011;2:472.
- Staub C, Hue D, Nicolle JC, Perrard-Sapori MH, Segretain D, Durand P. The whole meiotic process can occur in vitro in untransformed rat spermatogenic cells. Exp Cell Res. 2000;260(1):85-95.
- Lee JH, Kim HJ, Kim H, Lee SJ, Gye MC. In vitro spermatogenesis by three-dimensional culture of rat testicular cells in collagen gel matrix. Biomaterials. 2006;27(14):2845-53.
- Legendre A, Froment P, Desmots S, Lecomte A, Habert R, Lemazurier E. An engineered 3D blood-testis barrier model for the assessment of reproductive toxicity potential. Biomaterials. 2010;31(16):4492-505.
- Brinster RL, Zimmermann JW. Spermatogenesis following male germ-cell transplantation. Proc Natl Acad Sci U S A. 1994;91(24):11298-302.
- Schlatt S, Honaramooz A, Boiani M, Scholer HR, Dobrinski I. Progeny from sperm obtained after ectopic grafting of neonatal mouse testes. Biol Reprod 2003;68:2331–5.
- Geens M, De Block G, Goossens E, Frederickx V, Van Steirteghem A, Tournaye H. permatogonial survival after grafting human testicular tissue to immunodeficient mice. Hum Reprod 2006;21:390–6.
- Sousa M, Cremades N, Alves C, Silva J, Barros A. Developmental potential of human spermatogenic cells co-cultured with Sertoli cells. Hum Reprod. 2002;17(1):161-72.
- Riboldi M, Rubio C, Pellicer A, Gil-Salom M, Simón C. In vitro production of haploid cells after coculture of CD49f+ with Sertoli cells from testicular sperm extraction in nonobstructive azoospermic patients. Fertil Steril. 2012;98(3):580-590.
- Hermann BP, Sukhwani M, Winkler F, Pascarella JN, Peters KA, Sheng Y, et al. Spermatogonial stem cell transplantation into rhesus testes regenerates spermatogenesis producing functional sperm. Cell Stem Cell. 2012;11(5):715-26.
- Yang S, Ping P, Ma M, Li P, Tian R, et al. Generation of Haploid Spermatids with Fertilization and Development Capacity from Human Spermatogonial Stem Cells of Cryptorchid Patients. Stem Cell Reports. 2014;3: 663–675.
- Tanaka A, Nagayoshi M, Takemoto Y, Tanaka I, Kusunoki H, et al. Fourteen babies born after round spermatid injection into human oocytes. Proc Natl Acad Sci U S A. 2015; 112(47): 14629-34.
SPERM NASIL OLUŞUR
Çocuk sahibi olunabilmesi için erkekte sperm yapımının normal olması gerekir. Erkekte üreme hücreleri yumurtalarda yani testislerde yapılır. Testislerde sperm üretimi ergenlikten sonra başlar. Sperm yapımından öncelikle sorumlu hormonlar FSH, LH ve testosterondur. FSH ve LH beyinin hipofiz adı verilen özel bir bölümünde yapılarak kana verilir. Eksikliklerinde sperm üretimi bozulur. Erkeklik hormonu olarak bilinen testosteronun ise büyük kısmı testisler içerisindeki hücrelerde gerçekleşir. Eğer bu hormonun yapımı veya çalışmasında bir bozukluk söz konusuysa sperm üretimi de bozulur. Testosteron düşüklüğ aynı zamanda cinsel fonksiyonlar ile de yakından ilgilidir.
Üreme hücreleri testisler içerisindeki küçük kanalcıklarda gerçekleşir. Bu kanalcıkların her birinin uzunluğu yaklaşık 30-80 cm olup, hepsi uç uca eklense 360 m uzunluğunda oldukları görülür. Günde yaklaşık 10 milyon sperm hücresi üretilir. Belirli bir sayıdan sonra parçalanırlar. Normalde menide bulunan toplam hücre sayısı 20-200 milyondur.
Testislerde üretilen sperm meni kanallarından geçerek dışarı atılır. Bu geçiş sırasında çeşitli bezlerden salgılanan maddelerle beslenerek, kadın yumurta hücresini dölleyebilme yeteneği kazanır.
ERKEKTE HANGİ TAHLİLLER YAPILIR
SPERM TAHLİLİ
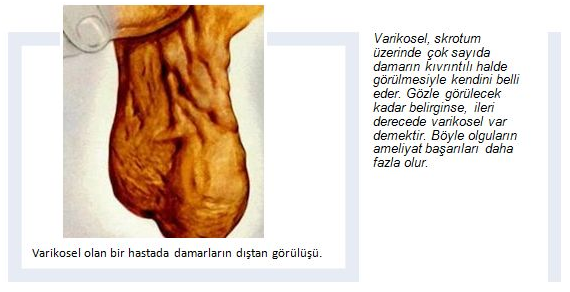
VARİKOSEL NEDİR
TESTİSLERİN YERİNDE BULUNMAMASI
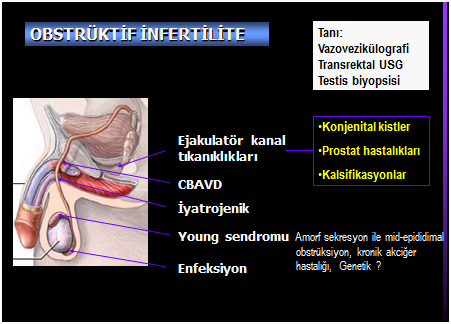
MENİ KANALLARINDA TIKANIKLIK
KISIRLIK İLE İKTİDARSIZLIK İLİŞKİSİ
NORMAL YOLLA ÇOCUĞUM OLMAZ MI?
KISIRLIĞIN İLAÇ İLE TEDAVİSİ
BESLENMEDE DİKKAT EDİLMESİ GEREKENLER
İNFERTİL ERKEKTE TEDAVİYİ DESTEKLEYİCİ TAVSİYELER
ERKEKTE KISIRLIK TEDAVİSİ İÇİN YAPILAN AMELİYATLAR
ÜREMEYE YARDIMCI TEKNİKLER NELERDİR
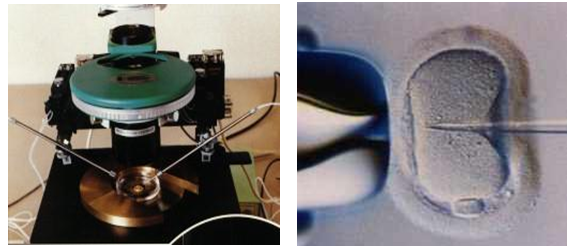
TÜP BEBEK, MİKROENJEKSİYON (ICSI) NEDİR?
ERKEĞİN TÜP BEBEKİÇİN HAZIRLANMASI
TÜP BEBEK SONUÇLARI NASILDIR?
TÜP BEBEK YAPILDIĞINDA HANGİ SORUNLAR ÇIKABİLİR?
KOPYALAMA NEDİR?