Prof.Dr. Kaan AYDOS
Cerrahi hazırlık
Optik büyütme
MikroTESE yöntemi mikrocerrahi gerektiren bir tekniktir. Cerrahın daha önce bu konuda deneyim sahibi olması işlemin başarısını artıracaktır. Testis yüzeyindeki damarların tanınması, seminifer tubüllerin izolasyonu ve diseksiyon sırasında kanama odaklarının koterizasyonu ile tunika albugineanın kapatılmasında yerine göre 8/0 sütür ile çalışılma gereksinimi, ancak optik büyütme ile mümkün olabilir. Optik büyütme, dokuların daha iyi ayırt edilmesine ve daha ince sütür materyallerinin kullanılmasına olanak verir. Optik luplar ile 2X – 8X’e kadar sabit büyütme sağlanmaktaysa da, büyütmenin artması ile görüş alanı daralıp, çalışma sahasına mesafe oldukça azalacağından, mikroTESE için lup kullanımı uygun değildir.
Operasyon mikroskopları yere sabitlenmiş olup, optik kısmı manuel ya da elektronik olarak ayarlanabilir. Gelişmiş tiplerde fokus ve zum fonksiyonlarının ayak pedalı kullanılarak ayarlanması mümkünse de, TESE sırasında testisin el ile manipüle edilmesi bu donanıma gerek bırakmamaktadır. Ameliyat mikroskopları 6X’dan 30X’a kadar büyütme sağlayabilirler. TESE işleminde tunika albuginea üzerinden damarların ayırt edilebilmesi için 6X – 8X büyütme yeterli olurken, tubüllerin seçilmesinde 20X – 25X’e, gerekirse 30X’e çıkılabilir.
Mikroskobun göz mercekleri (eyepieces), binoküler tüplerden ve mikroskop gövdesindeki merceklerden gelen gerçek görüntüyü 20X kat daha büyültebilen lensler içerir. Göz merceklerinin interpupiller mesafeye göre ayarlanması mümkündür. Binoküler tüpler, içlerindeki prizmalar sayesinde karşıya bakar pozisyondayken ameliyat sahasının görülebilmesini sağlar. Objektif lensleri ise, mikroskobun optik sisteminin en alt kısmında yer alırlar ve ameliyat sahasına fokus yapılan mesafeyi belirlerler. TESE için tercih edilen objektif lenslerinin fokus mesafeleri genelde 150 ile 200 mm arasında değişir. Büyütme artırıldıkça, görülen alanın çapı azalır ve sahaya daha yakın çalışmak gerekir. Aynı zamanda daha yoğun bir ışık kullanılma ihtiyacı ortaya çıkar. Artan ışık yoğunluğu ise çalışılan sahadaki dokularda kuruma yapabileceğinden, sık aralıklarla dokunun irrigasyonu gerekir.
Hasta ve cerrahın pozisyonu
Operasyon masasına hasta supin pozisyonunda yatar. Bacakları, altına bir destek konulmaksızın düz vaziyette uzatılır. Skrotumun mümkün olduğu kadar gömülü kalmaması sağlanmalıdır. Mikrocerrahi ayakta da yapılabilmekle beraber, daha kullanışlı ve rahat olması nedeniyle genelde oturur pozisyon tercih edilmektedir. Mikrocerrahi sırasında cerrah uzun süre sabit pozisyonda, tüm dikkatini çalışma alanına vermiş vaziyette çalışır. Bu nedenle fiziksel olarak rahat edebileceği optimum şartlar mevcut olmalıdır.
Ameliyat masasının yapısı ve ayakları cerrahın belinin ve dizlerinin bükülerek çalışmasına yol açmamalı, bacaklar masanın altına rahat yerleşmeli, bel dik pozisyonda olacak şekilde oturulmalıdır. Hasta masanın ayakucuna doğru kaydırılırsa, cerrahın bacaklarının masanın ayağından etkilenmeyecek konumda bir boşluğa gelmesi sağlanılabilir. Bu amaçla gerekirse hastanın ayakları bir tabure üzerine alınarak, iyice aşağı kayması sağlanmalıdır. Operasyon süresince masa hareketlerinin fokusu bozmaması için, masa en alt konuma kadar indirilir. Hatta, sedye şeklinde sabit masaların kullanılması da tercih edilebilir.
Ameliyata başlamadan önce, mikroskop steril örtülür ve ameliyat sahasına yönlendirilir. Başlangıçta en büyük büyütmeye göre ayarları yapılır. Asistanın görüşü ve video görüntüsü ayarlanır. Her iki göz merceği aynı fokusa getirilir, interpupiller mesafe ayarlanır. Yeterli fokus mesafesi sağlayacak lens seçilir. Binoküler tüpler, cerrahın rahat ve doğal pozisyonda oturur durumdayken 30o yatay açıyla öne ve aşağıya bakabilmesine müsaade edecek şekilde sabitlenir. El ve bileklerin operasyon sahasına dayanır vaziyette çalışılması, tremoru önleyerek, daha verimli çalışılmasını temin eder.
Cilt temizliği
Skrotum cildinin asepsisi antiseptik solüsyonlarla ile yıkanarak sağlanır. Sperme bulaşan antiseptik solüsyon zararlı olabileceğinden, cilt üzerindeki solüsyonun kuruması için 3-5 dk beklenmelidir. Eğer ıslaklık halen devam ediyorsa, steril tampon ile kurulanır. Bir kez de salin ile yıkanması antiseptik artıklarını uzaklaştıracaktır. İleride belirtileceği gibi, ciltte kullanılan aynı bistüri kesinlikle testisin açılmasında da kullanılmamalıdır.
Gerekli cerrahi aletler
Mikrocerrahi için kullanılacak malzemelerin mümkün olduğunca ince el hareketlerine uygun olması gerekir. El sırtı yere dayanarak çalışıldığı için, aletin de parmak uçları ile idare edilebileceği küçüklükte seçilmesi uygun olur. Tunika albugineanın kesilmesinde ucu sivri 15 numara, 5mm oftalmik bistüri, mikroskop altında küçük damarların arasından geçilmesinde kolaylık sağlar. Ayrıca, yuvarlak bistüri sapına takılmış sivri uçlu mikrocerrahi bıçak da seçilebilir. Burada dikkat edilmesi gereken nokta, skrotum cildinin açılmasında ayrı bir bistürinin kullanılmasıdır. Cilt üzerindeki antiseptik solüsyon artıklarının, mikroorganizmaların veya istenmeyen partiküllerin testis içine taşınması da bu yolla önlenilebilir. Cilt için 3 numara sapa takılmış yuvarlak uçlu 15 numara (BB 515; Aesculap Tuttlingen, Germany) küçük bıçak daha kullanışlıdır.
Kanama odaklarının koagulasyonu ise yine ince uçlu, küçük bipolar koter ucu kullanılarak ve düşük akımda çalışılarak sağlanmalıdır. Seminifer tubüllerin diseksiyonunda kullanılacak mikrocerrahi penset, tutma yeri kalın (plastik kaplamalı olabilir), kaymayan ve düz uçlu olmalı. Dişli uçlu olanlar doku travması yapabileceğinden tercih edilmemelidir. Bu amaçla Muller FM1, 110 mm, 43/8″ (Aesculapä, Tuttlingen, Germany) kullanılabilir. Doku makası olarak düz, uzun-yassı uçlu ve tutma yeri de yassı olanlar tercih edilmelidirler. Vannas FD18 160 mm, 61/4″ (Aesculapä, Tuttlingen, Germany) makas bunun için yeterlidir.
Tunikanın kapatılmasında atravmatik yuvarlak iğne takılı, 7-0 veya 8-0 absorbe olmayan, monoflamen, polipropylene (Prolyeneä, Ethicon, Cincinnati, OH) sütür travmatize etmeden ve oldukça estetik bir kapanma sağlayabilir. Absorbe olmaması nedeniyle, sonraki girişimlerde eski sütür hattının tanınması da mümkün olur. Dikiş devamlı olmalı ve kilitleyerek sürdürülmelidir. Tunika vajinalis’te ise 4-0 krome kat-güt de kullanılabilir. Sütür konulmasında manipülasyon kolaylığı nedeniyle tutma yeri yuvarlak, düz uçlu portekü önerilir. Kilitli portekü olması cerrahın tercihine kalmış olmakla birlikte, genelde rahat bir kullanım sağladığı söylenilebilir. Ancak, kilitin serbestleştirilmesi sırasında istenmeyen travmalara yol açması da mümkündür. Bu amaçla FD246 185 mm, 71/4″ portekü önerilebilir (Aesculapä, Tuttlingen, Germany).
İşlem sırasında görüşü kolaylaştırmak için, ucuna 20 g anjiokatater takılmış 20 ml enjektör ile aralıklı irrigasyon yapılmalıdır. İrrigasyon solüsyonu olarak sperm metabolizmasında bozulma yapmayacak ringer laktatın kullanılması uygundur.
Cerrahi teknik
Cilt temizliğini takiben hasta steril örtülür. Skrotum çevresinin tamamen çevrelenecek şekilde örtülmesi, ileride testisin cilt ile temasını önler. İşlem hafif sedasyon ile birlikte spinal kordun lokal infiltrasyon anestezisi ya da genel anestezi altında yapılabilir. Ancak, spermatozoa bulunamadığı zaman ameliyat 2 saat veya daha fazla uzayabileceğinden, lokal anestezinin etkisi kaybolup, hastanın aşırı ağrı hissedebileceği düşünülerek genel anestezi tercih edilebilir. Süre uzadığı zaman her ne kadar yeniden anestezik infiltrasyonu ile işleme devam edilebilirse de, dokuların ödemli olması nedeniyle her zaman istenen anestezi elde edilemeyebilir.
Lokal anestezide; spermatik kord iki parmak arasında kavranarak kaldırılır. Bu sırada testis aynı el yardımıyla aşağıya doğru gerdirilir. Diğer el ile, ucuna 25g iğne takılı 10 ml’lik bir enjektör kullanılarak, 2-5 ml 1:1 %1 Xylocaine ve %0.5 Marcaine karışımı, spermatik kordu çevreleyen eksternal spermatik fasia içerisine verilir. Burada en önemli nokta, spermatik kord tutulurken vaz deferensin de hissedilmesi ve infiltrasyonun mümkün olduğunca vaza yakın yapılmasına dikkat edilmesidir. Enjeksiyondan önce piston hafifçe geri çekilerek damara girme durumu kontrol edilir. Eksperimental çalışmalarda kord anestezisinin %5 olguda spermatik arteri travmatize ettiği gösterilmişse de, eksternal halkanın altından itibaren genelde birden fazla arter bulunduğu için testiste iskemi gelişmesinden korkulmamalıdır. Anestezinin yerleşmesi için 3-5 dk süre geçmesi beklenilir.
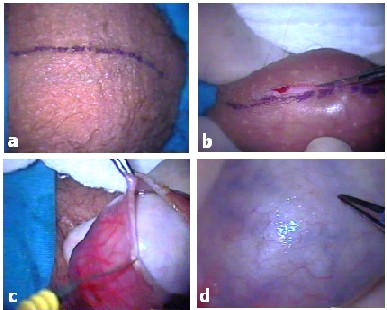
Daha sonra asistan testisi, üzerindeki cildi gerdirecek şekilde iki eli ile tutarak sabitler. Skrotal rafenin üste gelmesi sağlanmalıdır (Resim1a). Bu sırada epididimin testisin arkasında kalacak şekilde kesi alanından uzak tutulmasına dikkat edilmelidir. Yukarıda tanımlanan anestezik solüsyondan 1 ml, cilt ile tunika vajinalis arasına enjekte edilir. Testisin ön yüzünde, skrotal damarları zedelemeyecek şekilde rafe üzerinden vertikal bir kesi ile girilir (Resim 2b). İlk kesiyi yaptıktan sonra yara köşelerine bir miktar daha anestezik enjeksiyonu yapılarak kesi uzatılır. Cilt altı geçilirken, kanayan küçük damarların tamamının çok dikkatli koagule edilmesi, daha sonra cilt altında hematom gelişme riskini ortadan kaldırır. Arkasından, tunika vajinalis açılır ve testis dışarı çıkarılır (Resim 1c). Testisin skrotuma değmesini önlemek için etrafı steril örtü ile çevrelenmelidir.
Resim 1.
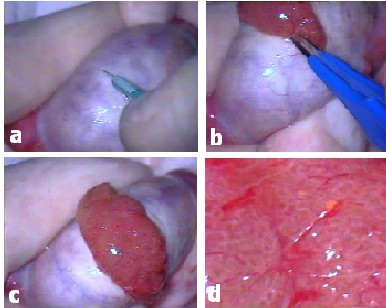
Tunika vajinalis dışına alındıktan sonra testis, cerrahın baş ve işaret parmakları arasında manipüle edilmeye başlanılır. Böylece değişik seviyelerde çalışılırken, testis aşağı-yukarı hareket ettirilerek mikroskobun foküs alanı içinde kalması sağlanılır. Testisin arterleri genel olarak efferent kanallar ve posterior kenar boyunca tunika albugineayı penetre ederek, testis içerisine girerler. Daha sonra değişik yönlerde subtunikal olarak dağılım gösterir ve interlobüler septalar boyunca parankim içerisine ilerlerler. Testisin arterleri end-arterler oldukları için, büyük bir arterin ya da çok sayıda küçük arterlerin yaralanması devaskülerizasyona, sonuçta da atrofiye neden olacaktır. Bu nedenle TESE sırasında tunika albuginea üzerinden yapılacak kesinin damarlara paralel ve transvers yönde, avasküler alandan geçmesi önemlidir (Resim 1d). 6X – 8X optik büyütme altında subtunikal vasküler yapı kolaylıkla ayırt edilebileceğinden, kesinin de damarlara temas etmeden, aralarından geçecek şekilde yapılması mümkün olacaktır. Oftalmik bistüri kullanılması, böyle bir hassas kesiye olanak tanır (Resim 2a).
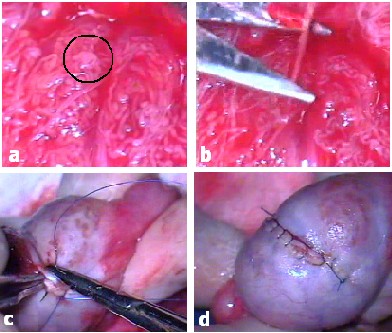
Tunikanın açılması sırasında diseksiyonu önleyebilecek damarlar koagule edildikten sonra kesilirler (Resim 2b). Daha sonra, 20X – 25X optik büyütmeye geçilerek testis parankimi incelenir (Resim 2c-d). Burada amaç; komplet spermatogenez içerebileceği daha önceki çalışmalarda ortaya konmuş olan, diğerlerinden daha dolgun ve daha opak-beyaz tubüllerin seçilmesidir (Resim 3a).
Fibrotik alanlar ve Sertoli cell-only tubülleri arasında böyle tubüller kolaylıkla ayırt edilebilirler. Nonobstrüktif azospermi olgularında bu tubüllerin görülebilmesi içinse, genellikle testis parankiminin geniş biçimde diseksiyonu gerekir. Testis üzerine el ile hafif basınç uygulanması, daha derindeki tubülleri de görüş alanına çıkarır. Bu sırada damarların mümkün olduğunca kesilmemesine dikkat edilmelidir. Kanayan damarlar ise koterize edilirler. Geniş koterizasyonun dokuda atrofiye neden olabileceği unutulmamalıdır. Koterizasyon sırasında bir enjektör ile ortamın ıslak tutulması, hem koagulasyonun etkisini artırır hem de koter uçlarına doku yapışmasını önler.
Daha sonra, seçilen tubüller penset yardımıyla tutularak kaldırılır ve mikrocerrahi makas ile kesilerek (Resim 3b), laboratuvarda ayrıştırılmak üzere içerisinde 3-5 ml sperm yıkama solüsyonu bulunan bir petri kutusuna alınırlar. Laboratuvardaki ayrıştırma sonucunda yeterli kalite ve miktarda spermatozoa görülmesi durumunda işleme son verilir. Eğer doku yeterli değilse, yeterli materyal elde edilinceye ya da daha fazla diseksiyonun artık testis beslenmesini bozacağına karar verilinceye kadar aramaya devam edilir. Optik büyütme altında normal yapıda tubül görülmez ise diğerlerinden daha matür olduğu düşünülenler kesilerek çıkarılır. Bütün tubüllerin aynı morfolojide olması durumunda ise mikroskop kullanılmaksızın testisin üst-alt-iç ve dış kenarlarından randomize biyopsiler alınarak uygulama sonlandırılır.
Resim 2.
Mikrodiseksiyon işlemi tamamlandıktan sonra çok dikkatli bir kanama kontrolü yapılır. Arkasından tunika albuginea yukarıda tanımlanan sütürler ile kapatılır (Resim 3c-d). Kapatma sırasında tunikanın fazla mobilize edilmesi kanamaya neden olabileceğinden, tunikadan oldukça az doku dikiş içerisinde bırakılarak, arteriyal beslenmenin zarar görmemesine dikkat edilmelidir. Daha sonra tunika vajinalis, cilt altı fasiaları ve cilt kapatılır.
TESE sırasında ameliyatın mikroskop kullanılarak yapılması hem vasküler travmayı minimalize ederek testis içerisinde hematom gelişme riskini ortadan kaldırır hem de çıkarılan doku volümünü anlamlı ölçüde azaltır. Gerçekten de bu yöntem, çıkarılan doku miktarını randomize biyopsileme ile çıkarılan doku miktarına göre oldukça azaltmaktadır (720 mg’a karşılık 9.4 mg).
Resim 3.
MikroTESE işleminde yeterli kalite ve kantitede spermatozoa bulma başarısı, çıkarılan dokunun laboratuvarda ayrıştırma işleminde kullanılan teknik ile de yakından ilgilidir. Sadece mekanik ayrıştırma kullanılarak yapılanlarla karşılaştırıldığında, enzimatik ayrıştırma eklenerek yapılan TESE işleminde spermatozoa elde etme oranları %36’dan %57’ye çıkmaktadır(Aydos Eur J Obst Gynecol Reprod Biol 2004).