Prof.Dr. Kaan AYDOS
Genomik imprinting olarak tanımlanan; germ hücrelerinin DNA’sında sitozin (CpG) bazlarının metilasyonu, o genin ekspresyonundan sorumlu mekanizmadır. Bu yolla anne ve babadan gelen allellerden sadece biri çocukta ortaya çıkar. Aileden gelen imprint’ler embriyonik germ hücrelerinde tamamen silinir. Gametogenez sırasında ya da fertilizasyondan sonra embriyonun cinsiyetine göre yeniden yerleşmeye başlar. Imprinting’in normal dışında seyretmesi anormal fötal gelişmeye ve Angelman’s sendromu ve Beckwith-Wiedemann’s sendromu gibi malin hastalıklara neden olabilir. Yakın tarihli çalışmalar bazı infertilite olgularından metilasyon bozukluklarının sorumlu olabileceğini düşündürmektedir.
İnfertil çiftlerin yaklaşık %70’inde sperme ait bir sorun bulunduğu görülmektedir (1). Bu sorun erkeğin üreme organlarındaki gelişim bozukluğuna bağlı olabileceği gibi, sperm üretim bozukluğuna da bağlı olabilir. Aslında spermin oositi fertilize ederek embriyoyu oluşturabilmesi için, bir yandan genlerinin sağlıklı biçimde eksprese olabilmesi gerekirken, diğer yandan da bazı genlerinin inhibisyonu gerekir. Genin inhibe edilmesi önemlidir, çünkü o gen eğer çalışırsa ürettiği faktör belki de spermatogenezde bazı basamakları baskılayacaktır (imprinting). İşte bir genin ekspresyonunun inhibe olabilmesi, bu genin sitozin bazına “metil grubunun” bağlanması ile gerçekleşir.
Daha açık olarak izah etmek gerekirse, normalde anne ve babadan gelen genler birlikte çocukta bir özelliğin ortaya çıkmasını sağlarlar. Oysa bazı genler vardır ki, sorumlu oldukları özelliğin ortaya çıkabilmesi için sadece anne ya da babadan gelmiş olması, diğer allelinin ise inhibe olmuş olması gerekir. İşte bu olaya “genomik imprinting” adı verilir (2). Örneğin, IGF2 (insulin-like growth factor-2)’yi kodlayan genin babadan gelen allelinin aktif, anneden gelen allelinin ise inaktif, yani imprinting sonucu inhibe edilmiş olması gerekir. Eğer her iki allelde de eksprese edilirlerse, örneğin sadece babanın genomunun kullanıldığı klonlama çalışmalarında olduğu gibi ya da annedeki genlerde bir imprinting bozukluğu olmuşsa, çocukta Wilm’s tümörü gelişir (3).
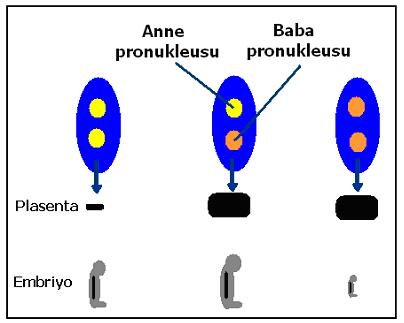
Şekil 1. Klonlama çalışmalarında anne ya da baba genomundan partogenetik embriyo üretilmesinin sonuçları.
Bunu başka örneklerle de desteklemek mümkündür. Klonlama çalışmalarında açıkça gösterildiği gibi, eğer sadece anneye ait pronukleuslar kullanılırsa, bundan gelişecek embriyo kısmen normal olurken, plasentası gelişememektedir. Diğer yandan, eğer sadece erkeğe ait pronukleuslar kullanılırsa, plasenta gelişecek ama embriyo gelişemeyecektir (şekil 1). Çünkü bazı genlerin ekspresyonları anne ya da baba genomunda baskılanmış olup, karşılıklarının diğer genomdan alınması gerekir (imprinting). Bunun eksikliğinde normal embriyo gelişimi gerçekleşemez (4,5,6). İşte imprinting, yani metilasyon, sağlıklı bir embriyo gelişmesinde böyle rol oynamaktadır. Allellerden birisi imprinte olduğunda, o genin fonksiyonu normal olacak iken, bu imprinting olmazsa genin normal fonksiyonu da bozulur (şekil 2).
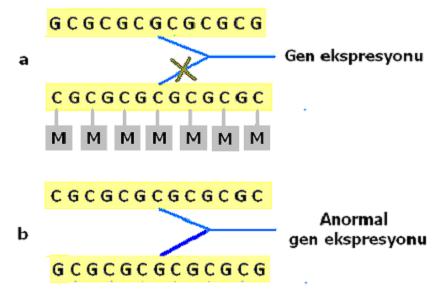
Şekil 2. Normalde anne ya da babadan gelen allellerden birinin baskılanması gerekirken (a), bu baskılanma ortadan kalkarsa o genin ekspresyonu da bozulur (b).
Günümüzde kabul edilen görüş hücrenin genomunun işlevini görebilmesi için major epigenetik düzenleyicinin DNA’nın metilasyonu olduğudur. Gerçekten de, bazı genlerin fonksiyonlarını yerine getirebilmesi ile DNA’sının metilasyon durumu arasında sıkı bir ilişki mevcuttur. DNA metilasyonu erkekte üreme organlarının gelişiminde, spermatogenezde ve seksüel davranışlar üzerinde kanıtlanmış etkiye sahiptir. Dolayısıyla, metilasyondaki bozukluklar beraberinde anormal seksüel gelişim ve üreme bozukluklarını da getirecektir.
Metilasyonun aksi ise “demetilasyon”, yani sitozine bağlanmış olan metil grubunun kalkarak, o genin tekrar fonksiyonuna başlayabilmesidir. İşte DNA üzerindeki genler metile ve demetile olarak, o hücrenin görevini yerine getirmesini sağlarlar. Bu metilasyon-demetilasyon durumu daha primodial germ hücreleri (PGH) evresindeyken işlemeye başlar, spermatogenez sürecinde devam ederek, fertilizasyonu takiben embriyo gelişimini ve sonuçta erişkin organogenezini ayarlar.
Sperm genomunda DNA metilasyonu spermatozoanın maturasyonunda son derece önemli bir reaksiyondur (7). Spermatogenez sırasında görülen DNA metilasyonuna ait olaylar eksperimental çalışmalarda açıkca gösterilmiştir (8). Bu konuda en çok 5-azacytidine adlı ilaçla yapılan çalışmalar yardımcı olmuştur. 5-azacytidine germ hücreleri çoğalırken, replikasyon sırasında DNA’nın yapısına girerek metilasyonunu önler (9). İşte bunun sonucunda, kondanse olmuş spermatid ve spermatozoa sayılarında azalma, preimplantasyon dönem embriyolarında da gelişim bozuklukları geliştiği ortaya konmuştur (10). Demek ki erkekte germ hücre genomunun metilasyonu, gerek spermatogenezin normal devam etmesinde gerekse fertilizasyonu takiben embriyo gelişiminde önemli role sahiptir. Genom imprinting bozukluklarının hipospermatogeneze yol açtığı ve oligozoospermik erkeklerin bu imprinting defektlerini çocuklarına da geçirdikleri gözlenmiştir (11).
Doğacak çocuğa genetik materyalin sağlıklı biçimde geçebilmesinde sperm DNA’sının bütünlüğü esastır. Genomik imprinting sayesinde embriyoda anne ya da babadan gelen kromozom allellerinden birinin inhibisyona uğraması neticesi sadece diğer allel faaliyete geçer . Embriyo gelişirken 3. haftasında daha yeni PGH oluşurken, bu embriyonik germ hücrelerindeki tüm imprinte olmuş genler serbestleşir, yani imprintingler ortadan kalkar. Embriyonun erkek yada kız yönünde gelişimine bağlı olarak gametler gelişirken bir süre sonra ya da fertilizasyonu takiben imprinting olayı yeniden başlar. Eğer bu sırada imprinting eksik kalırsa fetusun gelişimi de anormal olur, hatta malin hastalıklar ortaya çıkabilir (12). Örneğin ICSI sonrasında Angelman sendromu ya da Beckwith-Wiedemann sendromu gibi hastalıkların ortaya çıkışı, embriyoda anneden gelen allelde imprinting işleminin eksik kalması, yani bu genin metilasyona uğrayamamasına bağlanmaktadır. Benzer durum babaya ait alleldeki metilasyon eksikliği neticesi başka sendromlar şeklinde de görülebilir.
Gametogenez
Gametogenezde germ hücreleri önce proliferasyon, arkasından hücre siklusunda bir müddet duraklama ve devamında hücre farklılaşması olayları peşisıra birbirini izler (13). Erkek fare embriyonunda ilk PGH koitten sonraki 7.5 günde (dpc) görülür. Bunlar bir yandan gonadlara göç ederlerken aynı zamanda hızla çoğalmalarını da sürdürürler. Fötal Sertoli hücreleri ile çevrelenmesini takiben PGH’ne gonosit ya da prospermatogonia adı verilir. 13.5-15 dpc’den doğuma kadar gonositlerin çoğalması durur. Doğumdan sonra yeniden çoğalma başlayarak, spermatogonial stem cell’leri oluşturur ve bunlar arasında da bazıları 10. günden itibaren aktifleşerek farklılaşır ve mayoza girer (14). İnsanda da temelde benzer bir süreç işlemektedir.
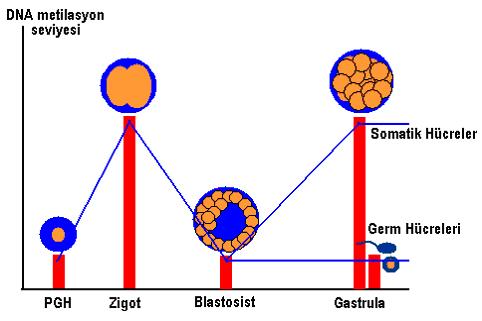
Şekil 3. Gametogenez sırasında farklı evrelerde gametlerin DNA’sının metilasyona uğrama dereceleri de değişir.
Primordial germ hücrelerinde metilasyon
PGH’leri gonadal kabartıya göç ederlerken geniş çapta bir demetilasyona uğrarlar, yani baskılanmış genler üzerindeki baskı kalkar, ve aileden gelen imprinting silinerek hücre farklılaşmasına olanak sağlanır. PGH DNA’sında metilasyon çok azdır. Gerçekten de, immünositolojik araştırmalarda, bu dönemde DNA üzerindeki metile olmuş sitozin rezidü sayılarının son derece azaldığı ortaya konmuştur (15). Bu dönemde aileden gelen imprinte olmuş, yani baskılanmış özellikler silinerek ortadan kalkmaktadır. Detaylı çalışmalar, PGC’lerin gonadal kabartılara göç ettikleri 10.5 ve 12.5 dpc arasında DNA’larında metilasyonların ortadan kalktığını (demetilasyon) göstermiştir (16). 12.5-13.5 dpc arasında artık erkek ve dişi germ hücrelerinin genomları aileden gelen imprinte olmuş lokusları da kapsayacak şekilde, kuvvetli bir hipometilasyon durumundadırlar (17).
Spermatogenezde DNA metilasyon değişiklikleri
Yukarıda da belirtildiği gibi, erkek farelerde PGH’leri gelişirlerken DNA’larında demetilasyonun görüldüğü bir dönem gelişir (şekil 3). Hemen bunun arkasından ise germ hücreleri çoğalmalarına ara verirler ve bu sırada nukleuslarında kuvvetli bir DNA metilasyonu başlar (18). Bu hipermetilasyon durumu germ hücrelerinin yeniden çoğalmaya başladıkları doğuma kadar sürer. Metilasyona uğrayan sekanslar artık transkripsiyon yapamaz duruma geçmişlerdir, yani sentez fonksiyonları inhibe olmuştur. Yine de bazı sekanslarda gen aktivitesinin devam ettiğinin gösterilmiş olması, bu tür sekansların aktivitelerinin DNA metilasyonu dışında başka faktörerden de etkileniyor olduğunu ya da metilasyonun hücreden hücreye farklılık gösterdiğini düşündürmektedir (19).
Her ne olursa olsun, doğumdan sonra DNA’daki hipermetilasyon durumu hücre bölündükçe azalmaya başlar (20).
Erişkin testisinde metilasyon
Testise spesifik genlerin büyük kısmı testiste demetile olup eksprese edilirlerken, ekspresyon yapmayan somatik dokularda metilasyona uğramış durumdadırlar. Bu da göstermektedir ki, DNA’nın metilasyon durumu genlerin ekspresyonlarında rol oynar (21). Erişkin erkekte spermatogoniumlar gelişirken, DNA replikasyonunu tamamlayıp mayoza girdiğinde genleri ya metile olur ya da metilasyonu ortadan kalkar. Ancak, anne ve babadan gelen allellerin metilasyona uğrama zamanları farklıdır. Babadan gelen allelin metilasyonu mayoz başlamadan önce olurken, anneden gelen allel mayoz sırasında metile olur (22). Spermatogenez sırasında DNA’nın global metilasyon derecesi değişir. Örneğin erişkin testisinin spesifik antikorlarla incelenmesiyle bütün hücrelerde metile olmuş sitozinler gösterilirken, bu metilasyon spermatositlerde görülmemektedir (23).
Farelerde primitif A tip spermatogoniumlarda DNA az metilasyona uğrarken, pakiten spermatositlerde, yuvarlak spermatidlerde ve epididmal spermlerde DNA’nın metilasyonu fazla olur. Germ hücreler gelişirlerken geç dönemlerde de yeni metilasyonlar görülebilir. Örneğin bazı genler sadece epididimden geçerken metilasyona uğrarlar (24). Bu da göstermektedir ki, spermatozoanın maturasyonunu tamamlaması için bazı genlerde DNA’nın metilasyonu gerekir.
Fertilizasyonda metilasyon
İnsanda erkek ve kadından gelen iki farklı kromatin seti birleşerek tek hücreli bir embriyo oluşturur. Erkekten gelen spermdeki kromatin içerdiği protaminler nedeniyle oldukça kondanse durumdayken, oositin kromozomları ise ikinci mayozun metafazında duraklamış halde olup, nukleozomu normal bir yapı gösterir. İşte iki taraftan gelen böyle farklı yapıdaki kromatin setleri dört-hücreli embriyo oluşana kadar farklılığını sürdürür ve ancak bundan sonra aralarındaki fark kaybolmaya başlar (25).
Bilindiği gibi, sperm ve oosit fertilizasyon sırasında metilasyona uğramaları nedeniyle transkripsiyon yapamazlar. Oysa diploid olduktan sonra embriyonun somatik gelişimi sürdürebilmesi için kromatin DNA’sı metilasyon durumunda değişiklik yaparak yeniden şekillenir. Bunun için erken embriyo devresinde babadan gelen genom fertilizasyonun ilk birkaç saati içerisinde demetilasyon geçirirken, anneden gelen genom iki-hücreli embriyo dönemini takiben sadece pasif bir demetilasyon süreci izler. Morula ve blastosist geliştikten sonra ise artık her iki genom da eşit metil kaybına uğramışlardır ve daha sonra yeni metilasyonlar oluşur (26).
Mevcut veriler tüm genomun, tek tek kromozomların ve spesifik genlerin metilasyonunun normal bir embriyo gelişiminde esas olduğunu göstermektedir (27). Nuklear transfer yapılan klonlama çalışmalarında sadece %0.1-3 arasında embriyoların normal gelişim gösteriyor olması, bunlarda anne genomu ve baba genomu farklılığının olmamasıyla izah edilmektedir (28). Çünkü klonlamada normal fertilizasyondan farklı olarak iki değişik genom bulunmadığı için, bunlardaki allellere ait farklı metilasyon özellikleri de ortadan kalkmış olacaktır. Bunların metilasyon durumları, aynı farklılaşmasını tamamlamış diploid somatik hücrelerindeki gibidir (29). Yani tek eşli embriyo fertilize olduktan sonra artık transplante edilen pronukleusun metilasyon durumunu değiştirememektedir (30). Belki de partogenetik üremenin başarılı olamama nedeni böyle bir metilasyon yetmezliğinden kaynaklanmaktadır.
Yukarıda tanımlanan fizyolojik olayların kliniğe yorumlanması önemli sonuçlar ortaya koyar. Sperm sadece babadan gelen genleri taşıyan bir haploid genoma sahiptir. Ebeveynlerden gelen imprinting erken evre embriyoda tamamen silindiği için, sperm sadece babada gelişecek yeniden metilasyon özelliklerini embriyoya taşır. Dolayısıyla, erkekte metilasyonu etkileyecek herhangi bir olay, doğrudan embriyo gelişimine de yansıyacaktır. 5 methyl-cytosine ile immünboyama yapıldığı zaman, astenozoospermik ve teratozoospermik erkeklerde spermin global metilasyon indeksi düşük olarak bulunmuştur. Metilasyon bozuklukları IVF/ICSI sonrası fertilizasyon ile negatif korelasyon verirken, metilasyonun arttığı olgularda gebelik başarısının da arttığı gösterilmiştir (31).
Sperm üretiminin bozulduğu oligozoospermik erkeklerde H19 geninin, ki bu genin spermatogenez sırasında premayotik evrede babadan gelen allelinin metilasyona uğrayarak imprinte olması ve bunun da bir supresör geni baskılaması neticesi IGF2’nin eksprese olması gerekir, metilasyonunun yetersiz olduğu gösterilmiştir (32). Normalde babadan gelen IGF2 geni bu mekanizma ile eksprese olurken, anneden gelen kromozomdaki IGF2 geni, supresör geni metilasyona uğramadığı için, inhibe durumda kalır. Oysa babaya ait allel yeteri kadar imprinte olamamışsa, yani supresör gen baskılanamamışsa, IGF2 de yeteri kadar eksprese olamayacaktır. Bu durumda hem anneden hem de babadan gelen kromozomlarda IGF2 eksprese olamayacağından, spermatogenez de normal işlemeyecek ve neticede oligozoospermi gelişecektir. Böyle bir spermatozoadan gelişecek embriyoda da her iki ebeveynden gelen IGF2 genleri eksprese olamayacağından embriyo gelişiminin de sağlıklı olması beklenemez. Daha kötüsü, eğer her iki ebeveynden gelen IGF2 de eksprese olsaydı çocukta Wilms tümörü gelişecektir. Demek ki, spermde imprinting bozuklukları embriyoya geçerek, embriyonun normal gelişimini etkileyebilmektedir. Bu konuda veriler çelişkilidir. Bazı çalışmalar spermatogenezdeki imprinting bozukluklarının tek başına embriyo gelişiminden sorumlu olmadığı yönündedir (33).
Sonuç olarak, sperm sayısında azalma ile beliren anormal spermatogenez durumunda, bazı genlerin yetersiz metilasyonu sorumlu olabilir. Erkek üreme sisteminin gelişiminde ve spermatogenezi etkileyebilen genlerin ekspresyonunda DNA metilasyonunun rolü, metilasyon bozukluklarının infertilitedeki önemine dikkat çekmektedir.
KAYNAKLAR
1. Cisneros FJ. DNA methylation and male infertility.Front Biosci 2004; 1:1189-200.
2. Paulsen M, Ferguson-Smith AC. DNA methylation in genomic imprinting, development, and disease. J Pathol 2005; 195: 97-110.
3. Wada M, Seeger RC, Mizoguchi H, Koeffler HP. Maintenance of normal imprinting of H19 and IGF2 genes in neuroblastoma. Cancer Res 1995; 55: 3386-8.
4. Barton SC, Surani MA, Norris ML. Role of paternal and maternal genomes in mouse development. Nature 1984; 311: 374-6.
5. Surani MA, Barton SC, Norris ML. Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature 1984; 308: 548-50.
6. Drewell Lab Biology Department University of Nevada, Reno Homepage http://unr.edu/homepage/rdrewell/index.html
7. Pontecorvo G, De Felice B, Carfagna M. Variability of DNA methylation pattern in somatic and germ cells in male newt (Amphibia, Urodela) Triturus cristatus carnifex. FEBS Lett 1998; 432: 77-81.
8. Kafri T, Ariel M, Brandeis M, Shemer R, Urven L, McCarrey J et al., Developmental pattern of gene-specific DNA methylation in the mouse embryo and germ line. Genes Dev 1992; 6: 705-714.
9. Michalowsky LA, Jones PA. Differential nuclear protein binding to 5-azacytosine-containing DNA as a potential mechanism for 5-aza-2′-deoxycytidine resistance. Mol Cell Biol 1987; 7: 3076-83.
10. Doerksen T, Trasler JM. Developmental exposure of male germ cells to 5-azacytidine results in abnormal preimplantation development in rats. Biol Reprod 1996; 55: 1155-62.
11. Marques CJ, Carvalho F, Sousa M, Barros A. Genomic imprinting in disruptive spermatogenesis. Lancet 2004; 22: 1700-2.
12. Gosden R, Trasler J, Lucifero D, Faddy M. Rare congenital disorders, imprinted genes, and assisted reproductive technology. Lancet 2003; 361: 1975-7.
13. Marchal R, Chicheportiche A, Dutrillaux B, Bernardino-Sgherri J. DNA methylation in mouse gametogenesis. Cytogenet Genome Res 2004; 105: 316-24.
14. Kluin PM, Kramer MF, de Rooij DG. Spermatogenesis in the immature mouse proceeds faster than in the adult. Int J Androl 1982; 5: 282-94.
15. Reynaud C, Bruno C, Boullanger P, Grange J, Barbesti S, Niveleau A. Monitoring of urinary excretion of modified nucleosides in cancer patients using a set of six monoclonal antibodies. Cancer Lett 1992; 61: 255-62.
16. Hajkova P, Erhardt S, Lane N, Haaf T, El-Maarri O, Reik W, et al. Epigenetic reprogramming in mouse primordial germ cells. Mech Dev 2002; 117: 15-23.
17. Lee J, Inoue K, Ono R, Ogonuki N, Kohda T, Kaneko-Ishino T, et al. Erasing genomic imprinting memory in mouse clone embryos produced from day 11.5 primordial germ cells. Development 2002; 129: 1807-17.
18. Coffigny H, Bourgeois C, Ricoul M, Bernardino J, Vilain A, Niveleau A, et al. Alterations of DNA methylation patterns in germ cells and Sertoli cells from developing mouse testis. Cytogenet Cell Genet 1999; 87: 175-81.
19. Dupressoir A, Heidmann T. Germ line-specific expression of intracisternal A-particle retrotransposons in transgenic mice. Mol Cell Biol 1996; 16: 4495-503.
20. Bernardino-Sgherri J, Chicheportiche A, Niveleau A, Dutrillaux B. Unusual chromosome cleavage dynamic in rodent neonatal germ cells. Chromosoma 2002a; 111: 341-7.
21. Hisano M, Ohta H, Nishimune Y, Nozaki M. Methylation of CpG dinucleotides in the open reading frame of a testicular germ cell-specific intronless gene, Tact1/Actl7b, represses its expression in somatic cells. Nucleic Acids Res 2003; 31: 4797-804.
22. Davis TL, Trasler JM, Moss SB, Yang GJ, Bartolomei MS. Acquisition of the H19 methylation imprint occurs differentially on the parental alleles during spermatogenesis. Genomics 1999; 58: 18-28.
23. Loukinov DI, Pugacheva E, Vatolin S, Pack SD, Moon H, Chernukhin I, et al. BORIS, a novel male germ-line-specific protein associated with epigenetic reprogramming events, shares the same 11-zinc-finger domain with CTCF, the insulator protein involved in reading imprinting marks in the soma. Proc Natl Acad Sci USA 2002; 99: 6806-11.
24. Xie W, Han S, Khan M, DeJong J. Regulation of ALF gene expression in somatic and male germ line tissues involves partial and site-specific patterns of methylation. J Biol Chem 2002; 277: 17765-74.
25. Mayer W, Smith A, Fundele R, Haaf T. Spatial separation of parental genomes in preimplantation mouse embryos. J Cell Biol 2000a; 148: 629-34.
26. Reik W, Dean W, Walter J. Epigenetic reprogramming in mammalian development. Science 2001; 293: 1089-93.
27. Neumann B, Barlow DP. Multiple roles for DNA methylation in gametic imprinting. Curr Opin Genet Dev 1996; 6: 159-63.
28. Solter D. Mammalian cloning: Advances and limitations. Nat Rev Genet 2000; 1: 199-207.
29. Dean W, Santos F, Stojkovic M, Zakhartchenko V, Walter J, Wolf E, et al. Conservation of methylation reprogramming in mammalian development: Aberrant reprogramming in cloned embryos. Proc Natl Acad Sci USA 2001; 98: 13734-38.
30. Barton SC, Arney KL, Shi W, Niveleau A, Fundele R, Surani MA, et al. Genome-wide methylation patterns in normal and uniparental early mouse embryos. Hum Mol Genet 2001; 10: 2983-7.
31. Benchaib M, Ajina M, Lornage J, Niveleau A, Durand P, Guerin JF. Quantitation by image analysis of global DNA methylation in human spermatozoa and its prognostic value in in vitro fertilization: a preliminary study. Fertil Steril 2003; 80: 947-53.
32. R Gosden, J Trasler, D Lucifero and M Faddy. Rare congenital disorders, imprinted genes, and assisted reproductive technology. Lancet 2003; 361: 1975-7.
33. Manning M, Lissens W, Liebaers I, Van Steirteghem A, Weidner W. Imprinting analysis in spermatozoa prepared for intracytoplasmic sperm injection (ICSI) International Journal of Andrology 2001; 24: 87.