Prof.Dr. Kaan AYDOS
Günümüzde erkek faktörü infertilite olgularının tedavisinde üremeye yardımcı teknikler (ÜYT) önemli bir yer tutmaktadır. Ancak yine de olguların yaklaşık yarısında istenilen başarı elde edilememektedir. ÜYT başarısızlıklarında neden çoğu kez ortaya konulamaz. Bu konuda geniş araştırmalar yapılmış olmakla birlikte, enfeksiyonun etkisi tam anlamıyla izah edilmiş değildir. Burada sorun, enfeksiyon etkeninin saptanmasındaki teknik yetersizlikler ile enfeksiyonun bir sonucu olarak olaya karışan diğer faktörlerin yeteri kadar irdelenmemiş olmasından kaynaklanmaktadır. Yapılan çalışmalar analiz edildiğinde, enfeksiyon etkeninin spesifik olarak tespit edilerek ortadan kaldırılmasının ve lökosperminin ya da lökosperminin sonuçlarının elimine edilmesinin ÜYT başarısını artırabileceği konusunda uyarıcı önemli kanıtlar edinilmektedir.
İnfertil erkeklerin seminal plazmalarında enfeksiyon bulunmasının önemi iki mekanizma ile izah edilebilir. Birincisi enfeksiyon etkenine ait faktörler; diğeri ise lökospermidir. Değişik yayınlarda bildirilen lökospermi (lökosit sayısının > 1 X 106/ml olması) insidansı %2 ile %23 arasında değişmektedir (1, 2). Bazen lenfositler ya da makrofajlar baskın olmakla birlikte, granülositler en yaygın lökosit türüdür. Bu da lökospermi etyolojisinden birden fazla faktörün sorumlu olabileceğini vurgulamaktadır.
Semeni infiltre eden lökositler spontan olarak ortama reaktif oksijen türevleri (ROS, reactive oxygen species) verme potansiyelleri ile bir oksidatif stres kaynağı oluştururlar (3). İnsan spermatozoası ise oksidatif strese karşı oldukça dayanıksızdır. Plazma membranlarının doymamış yağ asitleri bakımından çok zengin olmaları, serbest radikallerden ciddi olarak etkilenmelerine yol açar (4). Spermatozoanın sitoplazma volümünün ve dağılımının kısıtlı olması, antioksidan enzimlerden de yeteri kadar faydalanmasını önlemektedir.
Diğer yandan, semenin lökosit infiltrasyonu ile sperm kalitesi arasında in vivo şartlarda her zaman ters bir etki gösterilememiş olmakla birlikte, bazı çalışmalarda lökosit kontaminasyonunun semen kalitesini olumsuz yönde etkilediği yönünde sonuçlar bildirilmiştir (1, 5). Aslında böyle değişken sonuçlar, lökosit konsantrasyonunun 3 X 106/ml’nin altında kaldığı olgular için geçerlidir, bunun üzerindeki konsantrasyonlarda lökosperminin erkek fertilitesi üzerinde olumsuz etkileri belirgin hale gelmektedir (6). Burada sorun sadece oksidatif stresin gametler üzerine doğrudan etkisi olmayıp, sekonder seks glandlarının fonksiyonlarında neden oldukları bozukluklar da rol oynamaktadır (7).
Spermatozoanın lökositlerden kaynaklanan ROS saldırılarına karşı direnci, seminal plazmanın antioksidan gücünden kaynaklanmaktadır (8). Spermatozoa seminal plazma ile temas ettiği sürece, lökosperminin etkilerinden korunabilecektir. Ancak, ÜYT’de uygulamanın esasını oluşturan seminal plazmanın yıkanarak ortamdan uzaklaştırılması işlemini takiben, yıkama ile koruyucu enzimler de elimine edildikleri için, oksidatif stres belirgin hale gelecek ve neticede sperm fonksiyonlarını bozabilecektir (9). Bu nedenle seminal plazmadan ayrılan spermatozoa oksidatif strese karşı aşırı hassas hale gelir. Dolayısıyla, bir çok çalışmada bildirildiği gibi, düşük lökosit konsantrasyonlarının da spermatozoanın fertilizasyon potansiyelinde bozulmayı arttırdığı yorumları aslında bu mekanizmadan kaynaklanmaktadır (9). Bundan yola çıkılarak, IVF’de kullanılan kültür ortamlarına glutatyon, N-asetilsistein, hipotaurin ya da katalaz gibi antioksidanların katılmalarının faydalı olabileceği düşünülmektedir (10).
Aslında infertil erkeklerin büyük kısmı enfeksiyon bakımından asemptomatiktir. Semptomlardaki belirsizlik, semenin antibakteriyal etkisi, uretral kontaminasyonlar ve bazı patojenlerin kültür ortamlarında üretilmesinde güçlükler nedeniyle subklinik genital enfeksiyon tanısı koymak her zaman kolay olmayabilir. Bütün bu faktörler nedeniyle de, ortamda bakteri bulunup bulunmamasının seminal parametreler üzerine etkileri konusunda çelişkili sonuçlar bildirilmektedir. Örneğin bir çalışmada klinik olarak enfeksiyon bulgusu vermeyen 1000 infertil çift incelendiğinde, erkeklerin %83’ünün semenlerinde kültürde üreme saptanmış, bunların da yarısının potansiyel patojen mikroorganizmalar olduğu görülmüş (11). İlginç olarak, eşi de tetkik edildiğinde bu çiftlerin sadece %1’inde bakteri üremediği bildirilmekte. Bu da göstermektedir ki, erkek uretrası kadar kadında vajen ve serviks de geçici ya da komensal mikroorganizmalarca kontamine olabilmektedir. Dolayısıyla, sadece erkeğe ait bulgulara bakılarak yorum yapmak her zaman doğru sonuç vermeyebilir.
Bununla birlikte, bakteri varlığı ya da yokluğu ile infertilite sıklığı arasında kesin bir ilişkinin varlığı ortaya konmuş değildir (12). Benzer şekilde, semptomatik olmayan erkeklerde semenlerinde bakteri bulunup bulunmaması subklinik genital sistem enfeksiyonu tanısı koymada yeterli bir kriter olarak gösterilmemektedir. Yukarıda da belirtildiği gibi, burada klinik sonuç üzerine etkisi bulunabilecek çok sayıda faktör söz konusudur. Ancak bütün bu faktörleri değerlendiren geniş seriler üzerinde yapılacak çalışmalar ile konu aydınlığa kavuşabilecektir.
Erkek genital sisteminin nongonokoksik bakteriyal enfeksiyonları arasında en sık bulunanı gram negatif basiller, özellikle Escherichia coli‘dir. İn vitro ortamda gram negatif basillerin aglütinasyon yaparak sperm motilitesi ve canlılığını olumsuz yönde etkilediği gösterilmiştir (13). Ancak bunun klinik önemi kesinlik kazanmış değildir.
Klamidya trakomatis ve ureaplasma urealitikum (UU) cinsel yolla bulaşan, özellikle seksüel yönden aktif, 35 yaş altı genç, asemptomatik erkeklerin uretra ya da epididimlerinde yerleşebilen mikroorganizmalardır (14). Enfekte erkeklerin %10-25‘i asemptomatiktir (15).
Klamidyanın enfeksiyöz olan parçacığına elementer cisim adı verilir ve elektron-yoğun bir nukleotid içerir (16). Dış ortamda bulunan elementer cisim hücre yüzeyine yapışır ve arkasından endositoz ile içeri alınarak, hücre içinde yaşamına devam eder. Bu sırada dış çeperi koruyucu bir zar ile çevrelenir. Hücre içinde replikatif forma dönüşen bu cisimler zamanla bölünerek sayıca artarlar. Daha sonra hücre zarını parçalayarak bu cisimcikler enfeksiyöz form halinde tekrar dış ortama çıkar ve diğer hücreleri enfekte etmek üzere yayılırlar. Uretradan alınan yayma örneklerinin immünolojik teknikler kullanılarak incelenmesiyle klamidya tanısı konulabilir.
Klamidya invaziv olarak yayıldığında epididimo-orşit, testis atrofisi ya da obstrüksiyon yaparak infertiliteye yol açabilir (17). Bu mikroorganizmaların potansiyel olarak erkekte infertilite yapmaları mümkün görülmekle birlikte, klinik veriler bunu her zaman desteklememektedir (18, 19). Benzer şekilde UU için de bulgular çelişkilidir. Örneğin Gnarpe ve Friberg, infertil populasyonda (%85) semende UU üreme sıklığının, fertillere göre (%23) anlamlı derecede artmış olduğunu (20); Fowlkes ise pozitif UU kültürlü olgularda sperm motilite ve morfoloji bozuklukları sıklıklarında artış olduğunu ortaya koymuşlardır (21). Oysa diğer araştırıcılar bu bulguları desteklememişledir (22). Sonuç olarak, gerek klamidya gerekse UU sperm fonksiyonlarını olumsuz yönde etkileyebilmekle birlikte, bunun erkek infertilitesindeki önemi henüz kesinleşmiş değildir.
İntrasitoplazmik sperm enjeksiyonu (ICSI) erkek faktörü infertilite olgularının önemli bir kısmında tedaviyi sağlamaktadır. Bununla birlikte olguların yaklaşık yarısında fertilizasyon ya da implantasyon görülememekte, ya da düşük ile sonuçlanmaktadır. Diğer yandan ICSI’nin taşıdığı riskler de bildirilmektedir (23). ICSI’de sperm seçiminde günümüzde uygulanan esas, “motil ve morfolojisi normal” spermatozoanın kullanımıdır.
1986’da Moss ve ark. sperm donörlerinin serumlarında klamidyaya karşı IgM D-K antikorlarının geliştiğini gösterdi (24). Bunun üzerine bazı otörler, sperm başında lokalize bazı küçük nodüllerin mikroorganizmalara ait olabileceği yönünde görüş bildirmişlerdir (25). Gerçekten de Gomez, bazı gonokok suşlarının sperm membranından içeri doğru parmaksı proçesler oluşturarak girebildiğini göstermiştir (26). Buna göre, pili taşıyan gonokoklar pilileri yardımıyla sperm başına tutunmakta ve çok sayıda pili bir arada toplanarak adeta bir yumak teşkil etmekteydiler. Pili içermeyen suşları ise sperme doğrudan tutunmaktaydılar. Bunun sonucunda, fallop tüpleri içerisinde spermin ilerlemesi engellenebilirdi.
Diğer yandan, elektronmikroskopik çalışmalarda klamidyanın da insanda spermatozoa membranına bağlanabilme, hatta başının içerisine girebilme potansiyeline sahip olduğu ortaya konmuştur (27). Klamidyanın enfeksiyöz elementer cisimleri sperm başına girdikten sonra nukleus içerisine geçebilmektedirler. Neticede hem fertilizasyonu bozabilecek hem de kadına geçme riski taşıyabileceklerdir. Ultrastrüktürel bulgular, klamidyanın sperm kuyruk yapısına da bağlanabileceğini hatta içerisine penetre olabileceğini göstermektedir. Moss, spermin morfolojik incelemesinde başın hemen altındaki nodüler oluşumların aslında buraya tutunmuş mikroorganizmalar olabileceği yönünde görüş belirtmektedir (25).
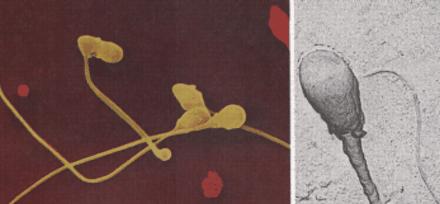
Figür 1: TR Moss tarafından BMJ 1996;313:1334-1335 (23 November)’makalesinde Mayor S. Technique for treating infertility may be risky. BMJ 1996;313:248. (3 August.)’ün yazısına atfedilen resimden alınmıştır. Moss; buradaki spermatozoaların boyun anomalilerinin, mikroorganizmaya bağlı partiküller tarafından meydana getirilmiş olabileceğini önermektedir.
Daha ilginç olarak, UU da sperm membranına bağlanarak, spermatogenezi önemli ölçüde bozabilmektedir. Xu, elektronmikroskopi ve immünfloresan teknik kullanarak insan spermatozoasının orta-parça ve post-akrozomal bölgelerine UU’un tutunduğunu göstermiştir (28). Bunun fertilizasyon üzerine etkilerini incelemek üzere ratlar UU ile enfekte edildiklerinde, seminifer tubüllerde dejenerasyon ve spermatogenezde belirgin bozulma gelişmiştir. Bunların da önemli bir kısmı infertil olmakta, enfekte ratlardan doğan yavrular ise kontrollere göre anlamlı derecede düşük doğum ağırlığında dünyaya gelmekteydiler.
Aslında mikroorganizmaların ICSI sırasında oosit içerisine taşınmasının önemi, bu organizmaların DNA içeriklerinin embriyoyu oluşturan genetik materyale karışarak, anormal embriyo gelişimine neden olma risklerinden kaynaklanmaktadır. Gerçekten de ICSI ile ilgili en önemli tereddütlerden birisi, işlem sırasında oosit sitoplazması içerisinde yabancı maddelerin de veriliyor olmasıdır (29). Bunun istenmeyen sonucu fertilizasyonun gerçekleşmemesi ya da embriyoda bazı anomalilerin ortaya çıkabilmesidir. Semen sıklıkla mikroorganizmalar tarafından kontamine haldedir. Bu mikroorganizmaların bir vektör gibi davranarak, genetik materyalleri ya da proteinleri oosite taşıyıp taşımadıkları konusu henüz açıklığa kavuşmuş değildir. Günümüz bilgileri, böyle bir tehlikenin en azından bakteriler için minimal olduğu veya hiç olmadığı yönündedir. Çünkü spermin antibiyotik içeren besi yerlerinde hazırlanıyor olması, IVF sırasında çok az miktarda (“100.000) spermatozoanın inseminasyona bırakılması ve kültür süresinin kısalığı bakteriler için bu riski azaltmaktadır (30).
Figür 2. Makoto Nagano, Takashi Shinohara, Mary R. Avarbock and Ralph L. Brinster Retrovirus-mediated gene delivery into male germ line stem cells FEBS Letters Volume 475, Issue 1 , 9 June 2000, Pages 7-10’den alınmıştır. Viral vektör kullanılarak germ hücreleri içerisine nakledilen işaretli genler, daha sonra alıcı hayvan testisine nakledildiğinde, germ hücreleri içerisinde bu genler izlenmekte. Buda eksternal kaynaklı DNA’nın spermatogenez sırasında germ hücreleri tarafından alınacağı ve kendi genetik materyali içerisine katılabileceğini düşündürmektedir.
Ancak, virüsler için durum şüphelidir. Viral DNA’nın sperme güçlü bağlarla bağlandığı ve içine girebildiği gösterilmiştir. Diğer yandan, ÜYT sırasında semenin yıkanarak hazırlanması mikroorganizmaları büyük oranda ortamdan uzaklaştıracaktır. Oysa semen hangi metodla hazırlanıra hazırlansın, virüs DNA’sı bağlanmış spermatozoalar ortamdan uzaklaştırılamamaktadır. Gerçekten de, HPV (human papillomavirus) ile kontamine semen yıkandıktan sonra bile HPV-DNA’sı taşıyan sperm hücrelerinin elimine edilemedikleri, bu DNA’ların hücre yüzeyine yapıştıkları ve büyük olasılıkla spermatozoanın içine girerek metabolizmasını etkilediği PCR ile yapılan çalışmalarda gösterilmiştir (31). Böyle yabancı DNA parçacıklarının spermatozoa içerisinde nasıl taşındıkları, taşınıyorlarsa ICSI sırasında oosite geçip geçmedikleri ve gelişecek embriyonun genetik yapısı ile birleşme durumları oldukça önemli problemleri de akla getirmektedir.
Virüslerin vektör olarak kullanıldığı çalışmalardan elde edilen sonuçlara dayanılarak, diğer mikroorganizmaların da aynı mekanizmayla DNA naklinde rol oynayabilecekleri son yıllarda araştırma konusu olmuştur. UU bir vektör gibi yabancı DNA parçalarını embriyoya taşıyabilmektedir. Bilindiği gibi mikoplazmalar hücrelerden kolayca geçebilme özelliğine sahiptirler. Ama bir vektör görevi yaptıkları ancak son yıllarda ortaya konabilmiştir. Blastosistler BRCA1 DNA’sı içeren besi yerinde inkübe edildiklerinde, eğer ortamda canlı UU bulunuyorsa bu DNA’nın blastosist içerisine girdiği, UU bulunmayan ya da ölü UU bulunan ortamlarda ise bunun gerçekleşmediği gösterilmiştir (32). Bu bulgular, UU ile enfekte semenlerin yıkansalar bile, IVF-ICSI sırasında bazı DNA fragmanlarını oosit ya da embriyo içine taşıma riski yarattıklarını önermektedir. Belki de, fertilizasyon başarısızlıkları veya embriyo kayıplarında bu mekanizma sorumludur.
Eğer sperm bir vektör gibi davranarak mikroorganizmaları ve dolayısıyla bunların DNA’larını ya da başka DNA’ları oosite taşıyabiliyorsa, bu DNA’nın embriyonun DNA’sı ile birleşme riski de söz konusu olmalıdır. Oosit içerisine taşınan yabancı genetik materyallerin, yeni oluşan embriyonun genetik materyali içerisine katılma riski değişik çalışmalarda araştırılmıştır. Eğer sperm inkübasyon sürecinde vektör DNA’sı ile birlikte bekletilirse, bu spemler ile ICSI yapıldığında, bazı çalışmalarda yavruların %85’inin bu DNA’yı taşıyan transgenetik yapıda oldukları gözlenmiştir (33). Erkekte germ hücreleri içerisine viral vektör kullanılarak gen nakledilmesi ve bundan da transgenic yavruların doğurtulması konusu ilk olarak Huang tarafından başarılmıştır (34). Araştırıcılar, rete testisten girilerek seminifer tubüller içerisine GFP (green fluorescent protein) içeren vektörler enjekte ettikten sonra bu yabancı DNA’ya ait floresan gösteren spermatozoaları toplayarak oosit içine mikroenjeksiyonlarını gerçekleştirdiklerinde, gerek fetusta gerekse doğan yavruda bu DNA’nın ekprese olduğunu göstermişlerdir. Benzer bulgular başka araştırıcılar tarafından da bildirimiştir (35).
Ayrıca, bazı nörodejeneratif hastalıkların etkeni olan prion proteinlerinin de teorik olarak ICSI sırasında taşınma riski mevcut görülmektedir (36). Benzer şekilde Perry de, dışarıdan eklenen DNA’nın ICSI sırasında oosite taşınarak genetik materyal içerisine karıştığını ve neticede bu DNA ile entegre olmuş transgenetik yavruların doğduğunu bildirmiştir (37). Yakın tarihlerde, yabancı DNA’nın ICSI ile oositlere taşınabileceği ve blastosist evresine kadar blastomerlerde eksprese olduğu primatlar üzerinde de gösterilmiştir (38). Her ne kadar doğan yavrularda transgen saptanmamış olsa da, sperme bağlı DNA’ların transgenetik canlı oluşturabilme riskinin mümkün olabileceği önerilmiştir. Bu durum özellikle ICSI sırasında enfekte spermler için bir risk yaratmaktadır. Gerçekten de, bakteriye ait kromozom parçacıkları sperm ile birlikte oosite enjekte edildiğinde, bu ekstra genetik materyalin büyük oranda yeni doğan canlının DNA’sına karışabildiği ortaya konmuştur (39).
Bütün bu sonuçlar değerlendirildiğinde, spermatozoa içerisinde yerleşerek klamidyanın ya da UU’un, veya UU’un bir vektör gibi davranarak ortamda bulunan yabancı DNA’ları spermatozoa içine taşımasıyla germ hücrelerinin böyle DNA’lar için bir taşıyıcı hale gelebildikleri, ICSI sırasında ise anormal genetik materyali oosite naklederek enfekte embriyoları oluşturabildikleri, bunun da doğacak canlıda risk oluşturabileceği anlaşılmaktadır. O halde, ICSI yapılmadan önce spermatozoanın dış kontaminasyonlardan etkilenebileceği bütün faktörlerin elimine edilmeleri gerekliliği ortaya çıkmaktadır (38). Her ne kadar klamidya ve UU pozitif semenlerin tedavilerini takiben gebelik oranları hakkında çelişkili raporlar bildirilmekteyse de, burada sağlıklı doğum üzerine etkili diğer faktörlerin de etkilerinin söz konusu olabileceği düşünülerek mikroorganizmaların öneminin gözardı edilmemesi, gerekli tedavileri yapıldıktan sonra ICSI uygulanmasının başarıyı daha artırabileceği kanısı edinilebilir.
KAYNAKLAR
1. Tomlinson MJ, Barratt CL, Cooke ID. Prospective study of leukocytes and leukocyte subpopulations in semen suggests they are not a cause of male infertility. Fertil Steril, 60: 1069, 1993.
2. Wolff H, Anderson DJ. Immunohistologic characterization and quantitation of leukocyte subpopulations in human semen. Fertil Steril, 49: 497, 1988.
3. Aitken RJ, West KM. Analysis of the relationship between reactive oxygen species production and leucocyte infiltration in fractions of human semen separated on Percoll gradients. Int J Androl, 13: 433, 1990.
4. Aitken RJ, Harkiss D, Buckingham DW. Analysis of lipid peroxidation mechanisms in human spermatozoa. Mol Reprod Dev, 35: 302, 1993.
5. Kaleli S, Ocer F, Irez T et al. Does leukocytospermia associate with poor semen parameters and sperm functions in male infertility? The role of different seminal leukocyte concentrations. Eur J Obstet Gynecol Reprod Biol, 89: 185, 2000.
6. Wolff H, Politch JA, Martinez Aet al. Leukocytospermia is associated with poor semen quality. Fertil Steril, 53: 528, 1990.
7. Gonzales GF, Kortebani G, Mazzolli AB. Leukocytospermia and function of the seminal vesicles on seminal quality. Fertil Steril, 57: 1058, 1992.
8. Jones R, Mann T, Sherins R. Peroxidative breakdown of phospholipids in human spermatozoa, spermicidal properties of fatty acid peroxides, and protective action of seminal plasma. Fertil Steril, 31: 531, 1979.
9. Aitken RJ, Clarkson JS. Significance of reactive oxygen species and antioxidants in defining the efficacy of sperm preparation techniques. J Androl, 9: 367, 1988.
10. Baker HW, Brindle J, Irvine DS, Aitken RJ. Protective effect of antioxidants on the impairment of sperm motility by activated polymorphonuclear leukocytes. Fertil Steril, 65: 411, 1996.
11. Eggert-Kruse W, Pohl S, Naher H et al. Microbial colonization and sperm–mucus interaction: results in 1000 infertile couples. Hum Reprod, 7: 612, 1992.
12. McGowan MP, Burger HG, Baker HW et al. The incidence of non-specific infection in the semen in fertile and sub-fertile males. Int J Androl, 4: 657, 1981.
13. Mardh PA, Colleen S. Search for uro-genital tract infections in patients with symptoms of prostatitis. Studies on aerobic and strictly anaerobic bacteria, mycoplasmas, fungi, trichomonads and viruses. Scand J Urol Nephrol, 9: 8, 1975.
14. Bar-chama N, Goluboff E, Fisch H. Infection and pyospermia in male infertility. Urol Clin North Am, 21: 469, 1994.
15. Karam GH, Martin DH, Flotte TR et al. Asymptomatic Chlamydia trachomatis infections among sexually active men. J Infect Dis, 154: 900, 1986.
16. Akman M, Gülmezoğlu E: Chlamydiae. Tıbbi Mikrobiyoloji. 3. baskı. Ankara, Hacettepe üniversitesi yayınları. 479-492, 1980.
17. Bowie WR. Nongonococcal urethritis. Urol Clin North Am, Feb; 11: 55, 1984.
18. Hellstrom WJ, Schachter J, Sweet RL, McClure RD. Is there a role for Chlamydia trachomatis and genital mycoplasma in male infertility? Fertil Steril, 48: 337, 1987.
19. Eggert-Kruse W, Gerhard I, Naher H et al. Chlamydial infection–a female and/or male infertility factor? Fertil Steril, 53: 1037, 1990.
20. Gnarpe H, Friberg J. Mycoplasma and human reproductive failure. I. The occurrence of different Mycoplasmas in couples with reproductive failure. Am J Obstet Gynecol, 114: 727, 1972.
21. Fowlkes DM, MacLeod J, O’Leary WM. T-mycoplasmas and human infertility: correlation of infection with alterations in seminal parameters. Fertil Steril, 26: 1212, 1975.
22. de Louvois J, Blades M, Harrison RF et al. Frequency of mycoplasma in fertile and infertile couples. Lancet, 1: 1073, 1974.
23. Mayor S. Technique for treating infertility may be risky. BMJ, 313: 248, 1996.
24. Moss TR, Nicholls A, Viercant P et al. Chlamydia trachomatis and infertility. Lancet, 2: 281, 1986.
25. Moss TR: Illustration of sperm may show attachment of potentially pathogenic micro-organisms BMJ, 313: 1334, 1996.
26. Gomez CI, Stenback WA, James AN et al. Attachment of Neisseria gonorrhoeae to human sperm. Microscopical study of trypsin and iron. Br J Vener Dis, 55: 245, 1979.
27. Erbengi T. Ultrastructural observations on the entry of Chlamydia trachomatis into human spermatozoa. Hum Reprod, 8: 416, 1993.
28. Xu C, Sun GF, Zhu YF, Wang YF. The correlation of Ureaplasma urealyticum infection with infertility. Andrologia, 29: 219, 1997.
29. Tournaye HJ, Van Steirteghem AC: Intracytoplasmic sperm injection: a tiem bomb? Assisted reproductive technology. Accomplishment and new horizons. (De Jonge CJ and Barratt CLR, ed) Cambridge, Cambridge university press. 397-406, 2002.
30. Michelmann HW. Influence of bacteria and leukocytes on the outcome of in vitro fertilization (IVF) or intracytoplasmic sperm injection (ICSI). Andrologia, 30 (Suppl 1): 99, 1998.
31. Brossfield JE, Chan PJ, Patton WC, King A. Tenacity of exogenous human papillomavirus DNA in sperm washing. J Assist Reprod Genet, 16: 325, 1999.
32. Chan PJ, Brossfield JE, Patton WC, King A. Mycoplasma-mediated uptake of the exogenous human BRCA1 gene by hatching blastocysts. J Assist Reprod Genet 16: 546, 1999.
33. Maione B, Lavitrano M, Spadafora C, Kiessling AA. Sperm-mediated gene transfer in mice. Mol Reprod Dev, 50: 406, 1998.
34. Huang Z, Tamura M, Sakurai T et al. In vivo transfection of testicular germ cells and transgenesis by using the mitochondrially localized jellyfish fluorescent protein gene. FEBS Lett, 487: 248, 2000.
35. Nagano M, Shinohara T, Avarbock MR, Brinster RL. Retrovirus-mediated gene delivery into male germ line stem cells. FEBS Lett, 475: 7, 2000.
36. Lacey RW, Dealler SF. Vertical transfer of prion disease. Hum Reprod, 9: 1792, 1994.
37. Perry ACF, Wakayama T, Kishikawa H et al. Mammalian Transgenesis by Intracytoplasmic Sperm Injection. Science, 14: 1180, 1999.
38. Chan AW, Luetjens CM, Dominko T et al. TransgenICSI reviewed: Foreign DNA transmission by intracytoplasmic sperm injection in rhesus monkey. Mol Reprod Dev, 56: 325, 2000.
39. Perry AC, Rothman A, de las Heras JI et al. Efficient metaphase II transgenesis with different transgene archetypes. Nat Biotechnol, 19: 1071, 2001.