Prof.Dr. Kaan Aydos
 Doğal yolla gebelik sağlanabilmesi için, ejakulatta yeteri sayıda hareketli ve olgun sperm hücrelerinin (spermatozoa) çıkması gerekir. Dünya sağlık örgütünün (WHO) son verileri normalde en az 15 milyon/mL spermatozoanın dışarı çıkması gerektiğini ortaya koymuştur. Bu sayının azalması, gebelik şansını da azaltır. Azoospermide ise, ejakulatta hiç sperm hücresi çıkmaz. İşte böyle olgularda testislerden mikroTESE tekniği ile olgun sperm hücrelerinin elde edilerek tüp bebekte kullanılması, çocuğu olmayan çiftlerin yaklaşık üçte birinde evlat sahibi olma yolunu açmıştır.
Doğal yolla gebelik sağlanabilmesi için, ejakulatta yeteri sayıda hareketli ve olgun sperm hücrelerinin (spermatozoa) çıkması gerekir. Dünya sağlık örgütünün (WHO) son verileri normalde en az 15 milyon/mL spermatozoanın dışarı çıkması gerektiğini ortaya koymuştur. Bu sayının azalması, gebelik şansını da azaltır. Azoospermide ise, ejakulatta hiç sperm hücresi çıkmaz. İşte böyle olgularda testislerden mikroTESE tekniği ile olgun sperm hücrelerinin elde edilerek tüp bebekte kullanılması, çocuğu olmayan çiftlerin yaklaşık üçte birinde evlat sahibi olma yolunu açmıştır.
TESE’nin mantığı, normalde testiste günde 30 milyon olması gereken sperm üretiminin çok azalması durumunda, dışarı çıkmaya gücü yetmeyen az sayıdaki sperm hücrelerinin bulunup, kullanılabilir hale getirilmesidir. Yani, TESE ile sperm bulunabilmesi için testislerde az da olsa sperm üretiminin olması gerekir. Eğer testislerde en azından bir miktar sperm üretimi varsa, acaba bu hücreleri bir şekilde menide çıkarabilir miyiz? Çünkü biliyoruz ki, bazı azoospermi olgularında ejakulatın çok dikkatli hazırlanması halinde birkaç tane de olsa olgun sperm hücresi meni tahlillerinde görülebilmekte. Bu duruma “pellet pozitif azoospermi” adı verilir. Hatta peş peşe bir aç kez meni çıkarıldığında, ilk örneklerde görülmese bile, sonrakilerde sperm hücrelerine bile rastlanabilinir. Demek ki, biraz zorlanırsa hiç TESE yapmaya gerek kalmadan ejakulattan da sperm elde edilebilir. Bunu kolaylaştırmanın bir yolu da, sperm taşıyan kanalların kasılma hızlarını artırmak olabilir.
 Gerçekten de, yapılan bilimsel araştırmalar sperm taşıyan kanalların ilaçlarla kasılma hızlarının artırılabileceğini ortaya koymuştur. Sperm taşınmasında en önemli kanal epididim bezidir. Testisin hemen arka-dış tarafında buna yapışık biçimde bulunur. Elle muayene edildiğinde de rahatlıkla fark edilebilir. Yaklaşık 5 metre uzunluğunda tek bir kanalın kendi üzerine kıvrılmasıyla meydana gelmiş bir bezdir. Testiste yapılan sperm hücreleri meni ile dışarı atılmadan önce bu kanaldan geçerler. Bu geçiş sırasında da daha olgun hale gelirler. Bir bakıma epididim, spermin olgunlaştığı yerdir.
Gerçekten de, yapılan bilimsel araştırmalar sperm taşıyan kanalların ilaçlarla kasılma hızlarının artırılabileceğini ortaya koymuştur. Sperm taşınmasında en önemli kanal epididim bezidir. Testisin hemen arka-dış tarafında buna yapışık biçimde bulunur. Elle muayene edildiğinde de rahatlıkla fark edilebilir. Yaklaşık 5 metre uzunluğunda tek bir kanalın kendi üzerine kıvrılmasıyla meydana gelmiş bir bezdir. Testiste yapılan sperm hücreleri meni ile dışarı atılmadan önce bu kanaldan geçerler. Bu geçiş sırasında da daha olgun hale gelirler. Bir bakıma epididim, spermin olgunlaştığı yerdir.
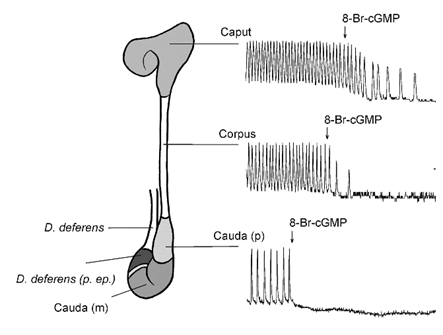
2006 yılında Almanya’nın Hamburg-Eppendorf Üniversitesinden bir grup araştırıcı, epididim kanalının kasılmasının cGMP denilen bir aracı molekül tarafından kontrol edildiğini gösterdi. cGMP epididimde kasılmayı azaltarak spermlerin geçiş zamanını uzatmaktaydı. Araştırıcılar, bu maddenin etkisini bloke ederek epididimlerin kasılma hızını artırmayı denediler. Bu amaçla da endometazin denilen bir ilacı kullandılar. Endometazin aslında çok eskiden beri ağrı kesici olarak romatizmada da kullanılan bir ilaçtır. Ama bir diğer etkisi ise cGMP’ın etkisini ortadan kaldırmasıdır. İşte, endometazin kullanıldığında cGMP etkisizleşmekte ve epididimin kasılması da anlamlı derecede artmaktaydı. Bu araştırmanın açık bir sonucu olarak, endometazinin epididimin kasılmalarını hızlandırıp, sperm hücrelerinin dışarı atılışını kolaylaştırdığı da anlaşılmış oldu (Mewe 2006).
Endometazinin sperm değerleri üzerine olumlu etkileri değişik çalışmalarda gösterilmiştir. En az 3 ay süreyle endometazinin kullanılması durumunda sperm sayı ve hareketinde anlamlı artış bildirilmiştir (Guo 2015, Sun 2005, Aydın 1995). Gebelik oranlarında da düzelme vardı. Endometazin kullanılan erkeklerde sperm motilite, sayı ve fertilizasyon oranlarındaki artışla birlikte FSH hormonu da yükselmektedir (Barkay 1984). Ancak endometazinin asıl etkisi oksidatif stresi azaltıp, sperm DNA hasarından koruyucu özelliğidir. Gerçekten de endometazin sperm üretiminde prostaglandinlerin zararlı etkilerini anlamlı derecede azaltmaktadır. Aynı zamanda cAMP ve MMP (sperm mitochondrial membrane potential) miktarını da artırmaktadır (Guo 2015). MMP, sperm sağlığının en önemli göstergelerindendir. Seminal plazmada ROS miktarıyla ters orantılı bir seviye gösterir (Wang 2003). Yani ROS arttıkça, MMP de düşer. Dolayısıyla MMP’nin artması, oksidatif stresin önlenmesinde etkin bir tedavi olabilir. Çünkü MMP mitokondride enerji kaynağı olan ATP’nin yapımında görev alır. Sperm hareketi ve canlılığı ise ATP miktarı ile ilişkilidir. Spermde ATP ne kadar yükselirse, gebelik şansı da o kadar artar (Bilgeri 1987). İşte endometazin kullanılmasının spermde hem ATP hem de MMP miktarını artırdığı gösterilmiştir. Bu da bir yandan hareketli sperm sayısını artıracak hem de spermleri serbest oksijen radikallerinin zararlı etkilerinden koruyarak DNA hasar oranını düşürecektir.
Bir nonsteroid antiinflamatuvar ilaç olan endometazinin spermler üzerine zararlı bir etkisi olup olmadığı da araştırılmış ve ne sperm parametrelerinde ne de FSH, Testosteron hormonlarında olumsuz hiçbir değişiklik ya da bozulma yapmadığı kanıtlanmıştır (Knuth 1989). Diğer yandan, aşılama ya da tüp bebek tedavisine girecek erkeklerde bu tür iltihap dağıtıcı ilaçların kullanılmasından sonra seminal plazmadaki lökositlerin azaldığı ve buna paralel olarak sperm parametrelerinde düzelme görüldüğü de ortaya konmuştur (Gambera 2007). Ayrıca, tedavi edilmedikleri takdirde lökositler sperm DNA hasarına da yol açarak döllenme başarısını önemli ölçüde düşürebilirler.
Bütün bunları göz önüne alarak biz de azoospermi olgularında kısa süreli endometazin tedavisiyle, menide sperm hücresi çıkarmayı öneriyoruz. Gerçekten de, tüp bebek tedavisine giren bir kısım erkekte TESE’ye gerek kalmadan ejakulatta çıkan spermleri kullanabildik. Böylelikle belki bazı hastalarda TESE yapmaya gerek kalmadan, menide çıkan spermlerle tüp bebek yapılabilecektir. Bir grup olguda başarılı olmakla birlikte etkinliğini kanıtlamak için henüz yeterli bir birikime ihtiyaç vardır. Özellikle psödoefedrin ile birlikte kullanılmasının daha başarılı olduğu kanısındayız.
Şekil 1. Epididim bezi baş (caput), gövde (corpus) ve kuyruk (cauda) olmak üzere 3 bölüme ayrılır. Normal durumda cGMP (siklik guanozin monofosfat) epididim kanalının kasılmalarını bloke eder. Endometazin ise cGMP’nin çalışmasını engeller ve böylece kasılmaları artırır. Kasılmaların artışı neticesi kanal içinden spermler daha kuvvetli ve hızlı biçimde dışarı atılabilirler. İşte tedavide de endometazin verilmesi, bu mekanizma ile sperm çıkışını artırıyor olabilir (Mewe 2006).
KAYNAKLAR
Mewe M, Bauer CK, Müller D, Middendorff R. Regulation of spontaneous contractile activity in the bovine epididymal duct by cyclic guanosine 5′-monophosphate-dependent pathways. Endocrinology. 2006 Apr;147(4):2051-62.
Aydin S, Inci O, Alagöl B. The role of arginine, indomethacin and kallikrein in the treatment of oligoasthenospermia. Int Urol Nephrol. 1995;27(2):199-202.
Sun SP, Shang XJ, Huang YF. Comparison of clinical efficacy between Huorongbushen and indomethacin in patients with oligospermia or asthenospermia. Zhonghua Nan Ke Xue. 2005 Aug;11(8):621-3.
Knuth UA, Kühne J, Crosby J, Bals-Pratsch M, Kelly RW, Nieschlag E. Indomethacin and oxaprozin lower seminal prostaglandin levels but do not influence sperm motion haracteristics and serum hormones of young healthy men in a placebo-controlled double-blind trial. J Androl. 1989 Mar-Apr;10(2):108-19.
Gambera L, Serafini F, Morgante G, Focarelli R, De Leo V, Piomboni P. Sperm quality and pregnancy rate after COX-2 inhibitor therapy of infertile males with abacterial leukocytospermia. Hum Reprod. 2007 Apr;22(4):1047-51.
http://www.cjurology.com/testmass.html
Barkay J, Harpaz-Kerpel S, Ben-Ezra S, Gordon S, Zuckerman H. The prostaglandin inhibitor effect of antiinflammatory drugs in the therapy of male infertility. Fertil Steril. 1984 Sep;42(3):406-11.
Bilgeri YR, Winchelmann A, Berzin M et al (1987) Adenosine triphosphate levels in human spermatozoa. Arch Androl 18:183
Wang X, Sharma RK, Gupta A et al (2003) Alterations in mitochondrial membrane potential and oxidative stress in infertile men: a prospective observational study. Fertil Steril 80 (Suppl
2):844–850