Aşağıda WHO semen ve sperm-servikal mukus etkileşimi araştırması laboratuvar manual’i (UK, Cambridge University Press, 1999) esas alınarak, temel olarak yapılması gereken testler verilmiştir. Araştırma ve tedavi amacıyla ilgili başka uygulamalar da eklenilebilir.
-
Sperm boyaması ve morfolojik değerlendirimi
-
Sperm yıkanması, zenginleştirilmesi ve hazırlanması (tetkik veya ÜYT’de kullanılmak üzere)
-
Testis dokusunun sürüntü preparatlarının sitolojik tetkiki
-
Sperm-servikal mukus etkileşim testleri (in vitro veya in vivo – PCT)
-
Seminal plazma markırlarının araştırılması (früktoz, sitrik asit, çinko, asit fosfataz, alfa-glükozidaz)
-
Akrozom reaksiyonu ölçümü
-
Prostat ve veziküla seminalis sekresyonlarının incelenmesi
-
İdrarda spermatozoa aranması
-
Diğer sperm fonksiyon testleri
- Androloji laboratuvarlarında Kalite kontrolü ve Standardizasyon
- İleri sperm fonksiyon testleri (sperm-servikal mukus etkileşimi; hyalüronik asit; sperm-oosit etkileşimi; sperm penetrasyon testleri; akrozom reaksiyonu testleri; DNA sağlamlığı, oksidatif stresin ölçülmesi)
Sperm toplanması
Sperm toplanmadan önce en az 48 saat, en fazla 7 günlük cinsel perhiz süresinin olması gerekir. Sperm toplanması için kullanılan kaplar cam ya da plastik olabilir. Toplama kapları temiz olmalı ve sperme toksik bir madde içermemelidir. İdeali bunun için özel amaçla yapılmış sperm toplama kaplarının kullanılmasıdır. Mikrobiyolojik analizlerde veya ÜYT için kullanılacaksa, steril olması tercih edilmelidir. Kabın üzerine hasta adı ve toplama saati mutlaka kaydedilmelidir.
En az iki sperm örneği incelenmelidir. İki sperm örneğinin toplanması arasında klinik değerlendirime göre en az 7 gün en fazla 3 ay süre geçmesi gerekir. Sperm sonuçları arasında anormal farklılıklar varsa örnekleme tekrar edilmelidir.
İdeali spermin, laboratuvara yakın bir yerde toplanarak bekletilmeden ulaştırılmasıdır. Eğer dışarıdan getiriliyorsa 1 saat içinde laboratuvara teslim edilmesi gerekir. Taşıma sırasında vücut ısısında tutulmalı, 20oC’dan düşük yada 40oC’dan yüksek ısılarda bırakılmamalıdır. İlk analizde hızlı-ileri sperm motilitesinin %25’den az olduğu olgularda ikinci örnek toplanırken bu süre daha kısa tutulmalıdır.
Ejakulat masturbasyonla toplanmalıdır. Bunun başarılamadığı olgularda toksik madde içermeyen, özel olarak yapılmış kondomlar da kullanılabilir.
Laboratuvar personeli sperm örneklerinin virüs bulaştırabileceği konusunda dikkatli olmaları gerekir.
Spermin fiziksel incelemesi
Likefaksiyon: Normal bir sperm örneği oda ısısında 60 dakika içerisinde likefiye olmalıdır. Likefaksiyon sonunda örneğin iyice karıştırlması yapılmalıdır. Bunu likefaksiyon süresince aralıklı veya sürekli olarak yapılması da tercih edilir. Likefiye olmayan spermlerin incelenmesini kolaylaştırmak amacıyla içerisine bromelin 1g/l, plasmin 0.35-0.50 U/ml veya kimotripsin 150 USP/ml katılabilir. Ancak bu maddelerin sperm fonksiyonları üzerine olumsuz etkide bulunup bulunmadıkları tam olarak bilinmemektedir.
Görünüm: Spermin muayenesi hemen likefaksiyondan sonra ya da 1 saat içerisinde yapılmalıdır. Normalde homojen, gri-opelasan görünümdedir. Opasifikasyonun azalması sperm konsantrasyonunun düşük olduğunu düşündürmelidir. Kahverengi-kırmızı örnekler eritrosit bulunduğunu akla getirir.
Volüm:Ejakulatın volümü dereceli, konik tabanlı silindir tüplerde yapılabilir veya geniş bir dereceli pipete çekilerek de tayin edilebilir. ÜYT’de kullanılacak ya da mikrobiyolojik tahlil yapılacaksa steril malzeme kullanılmalıdır. Plastik enjektörler ve hipodermik iğneler bu amaçla kullanılmamalıdır çünkü sperm motilitesini olumsuz etkileyebilirler.
Viskozite:Likefiye olduktan sonra ejakulat 5 ml’lik bir pipete çekilir ve kendi ağırlığı ile pipetin ucundan damlaması sağlanır. Bu sırada akarak uzayan damlanın boyu ölçülür. 2 cm’den fazla uzaması viskozitenin artmış olduğunu gösterir. Normalde ejakulat pipetin ucundan sarkmadan, küçük damlalar halinde dökülmelidir. Bir diğer yöntemde ise, cam bir çubuk ejakulatın içine daldırılır, arkasından geri çekilir. Bu sırada oluşan cam çubuğa yapışık ejakulat uzunluğu yüzeyden itibaren 2 cm’den fazla olmamalıdır.
Artmış viskozite sperm motilite ve konsantrasyon sonuçları ile antisperm antikor testlerini olumsuz etkileyebilir.
pH:Bunun için 6.1 – 10.0 arasında pH ölçebilen indikatör kağıtlar kullanılır. Bir damla sperm bu kagıt üzerine damlatılır. Oluşan renk değişimi, skala ile karşılaştırılarak pH tayin edilir. pH tayini ejakulat alındıktan sonra 1 saat içerisinde yapılmalıdır. Normali 7.2 – 8.0 arasında olmasıdır. 7.0’ın altındaki değerler vaz agenezi veya seminal vezikül agenezini, ejakulatör kanal obstrüksiyonlarını, vb. düşündürmelidir.
Mikroskopik muayene
İlk muayenede sperm konsantrasyonu, motilitesi, aglütinasyon ve spermatozoa dışı hücrelerin varlığı araştırılır. Taze preparatların incelenmesinde faz-kontrast mikroskop kullanılması, ışığın lam üzerinde saçılmasını önlemesinden dolayı, tercih edilmelidir. 10 mikrolitre’den fazla olmayacak şekilde bir damla semen mikropipet yardımıyla bir lam üzerine konur. Üzerine 22mm x 22mm lamel ile kapatılır. Bu şekilde yaklaşık 20 mikrometrelik bir derinlikte semen araştırılmış olunur. Bu hacim içerisinde spermatozoaların bütün rotasyon hareketleri de incelenebilmektedir. Daima aynı değerlerin kullanılarak sperm analizinin yapılması, sonuçların standardize edilebilmesi açısından son derece önemlidir.
Mikroskopik inceleme 400 – 600 x büyütmede yapılmalıdır. Hazırlanan preparatın 37oC’da muayene edilmesi uygun olur. Eğer 20-24oC’lık oda ısısında yapılıyorsa, sonuçların bu değere göre standardize edilmesi gerekir.
Preparat hazırlandıktan sonra 1 dakika bekenilerek, bu süre içerisinde stabilizasyon sağlanılır.
Sperm yoğunluğunun her mikroskop alanında belirgin farklılık göstermesi, ejakulatın homojen olmadığını gösterir. Bu durumda semen tekrar karıştırılmalıdır. Ayrıca bu durumdan, likefaksiyon bozukluğu, viskozite bozukluğu, spermatozoa agregasyonu (mukus lifleri arasında) yada aglütinasyon da sorumlu olabilir. Böyle bir gözlemin sperm analiz raporunda belirtilmesi gerekir.
Sperm sayısı düşük olan olgularda ejakulat önce 600 x g’de 15 dakika santrifüj edilerek, fazla seminal plazma atılır, geri kalan sabit volümde semen iyice karıştırılarak muayeneye alınır. Sonuç hesaplanırken, atılan seminal plazma volümü de dikkate alınmalıdır. Sperm motilite ve morfolojisi de santrifüj sonrası örnekte bakılmalıdır.
Motilite tayini
Her bir spermatozoanın motilitesi 4 derece üzerinden değerlendirilerek kaydedilir:
a. ileri-hızlı
b. ileri-yavaş
c. yerinde hareketli
d. hareketsiz
4-6 mikroskop alanı taranarak 100 spermatozoa sayılır. Her bir spermatozoa hangi kategoriye göre hareket ediyorsa kaydedilir. Her kategori için ortalama yüzde değerleri hesaplanır. Aynı işlem ayrı bir semen damlası alınarak 2 kez tekrarlanmalıdır. İki ölçüm arasında %10’dan fazla fark bulunmamalıdır. Aksi takdirde tetkik bir kez daha tekrarlanır. Sonuçta iki inceleme neticesinin ortalaması alınır.
Ejakulatta spermatozoa dışında uretradan gelen poligonal epitel hücreleri, spermatogenetik germ hücreleri, ve lökositler de bulunur. Bunların hepsine genel olarak “yuvarlak hücre” denir. Taze preparatların incelenmesi sırasında yuvarlak hücre konsantrasyonlarının da tayin edilmesi gerekir.
Lökositler çoğu ejakulatta görülürler. En sık nötrofillere rastlanılır. Lökosit sayısının çok dikkatli saptanması gerekir, çünkü lökospermi durumunda genital sisteme ait bir enfeksiyon söz konusu olabilir ve antibiyotik tedavisi gerekir. Lökositospermi aynı zamanda oksidatif stres ve/veya sitotoksik sitokinleri ortama vererek ejakulat volümünde azalma, oligoastenozoospermi, ve sperm fonksiyonlarında bozulmalara yol açabilir.
İnfertiliteye neden olabilecek lökosit sayısını belirlemek çok güçtür. Bu hücrelerin önemi ejakulata nereden geldikleri, tipi ve aktivasyon durumlarına bağlıdır. Özellikle rete testis yada epididimden ejakulata giren nötrofil lökositlerin neden oldukları oksidatif strese spermatozoalar daha hassastırlar. Oysa ejakulasyon sırasında prostat veya seminal veziküllerden ejakulata giren lökositler, seminal plazmanın güçlü antioksidan etkisi nedeniyle daha az zarar verircidirler. Genel olarak normal bir ejakulatın 5 milyon/ml’den fazla yuvarlak hücre ve 1 milyon/ml’den fazlada lökosit içermemeleri gerekir.
Semendeki lökositleri saymak için değişik teknikler kullanılmaktadır. ELISA ile elastaz konsantrasyonunun tayini bunlardan biridir. Hücre içi peroksidaz ve lökosite spesifik antijen tayinleri de kullanılmaktadır.
Lökosit sayısı ile genital enfeksiyon varlığı arasında kesin bir ilişki kurulamamıştır. 1 milyon/ml’nin üzerinde lökosit bulunduğu durumlarda genital glandlara ait bir enfeksiyonun varlığı yönünden araştırma yapmak uygun olur. Bu durumda ilk idrar, ikinci idrar, prostat masajı ile prostat sekresyonu ve masaj sonrası idrar olmak üzere 4 ayrı kültür gerekir. Aynı zamanda genital bezlere ait seminal plazma markırları da tayin edilerek, enfeksiyonun bu glandlarda bir patoloji yapıp yapmadığı araştırılmalıdır. Bununla birlikte, semende lökosit bulunmaması genital sisteme ait bir enfeksiyonun varlığını ekarte etmez.
Spermatid, spermatosit ve spermatogoniumlar lökositlerden ayırd edilmelidirler. Sadece kuyruğu gelişmiş matür germ hücreleri olan spermatozoalar sperm sayımında geçerlidir. Lökositler ve diğer yuvarlak hücrelerin spermatozoa sayısına göre oranları hesaplanarak ayrıca belirtilmeleri gerekir.
Burada C = (N x S) / 100 formülü uygulanır. N aynı alanda sayılan yuvarlak hücre tipi (örneğin lökosit yada diğer hücreler), S mililitredeki spermatozoa sayısı, C ise araştırılan bu hücre tipinin mililitrede milyon olarak sayısını göstermektedir. Örneğin spermatozoa sayısı 120 milyon/ml ve her 100 spermatozoa için 10 immatür germ hücresi sayılmışsa, (10 x 120 x milyon) / 100 = 12 milyon immatür germ hücresi / ml bulunduğu anlaşılır.
Aglütinasyon
Spermatozoanın aglütinasyonu demek motil spermatozoaların baş-baş, orta parça-orta parça, kuyruk-kuyruk yada benzer şekillerde birbirlerine yapışmaları anlamına gelir. İmmotil spermlerin birbirlerine yapışmaları ya da motil olup mukus iplikçiklerine veya spermatozoa dışı hücrelere ve debrislere yapışmaları nonspesifik agregasyonlar olarak kabul edilir ve mutlaka ayrıca belirtilmeleri gerekir.
Aglütinasyonun bulunması immünolojik nedenli bir infertilite olabileceğine kesin olarak işaret etmez. Aglütinasyon tayini random olarak seçilmiş 10 ayrı alanda sayılarak yapılmalıdır. Birbirine yapışmış motil spermatozoaların yüzde olarak hesaplanması şeklinde ifade edilir. Aglütinasyonun yaygınlığı önemli olduğu için, az da olsalar mutlaka not edilmelidir. Ayrıca aglütinasyonun türü de kaydedilmelidir (baş-baş, vb).
Mikroskopik inceleme sırasında yapılacak diğer araştırmalar
Sperm vitalitesi tayini (eozin boyaması, HOS testi – hipoozmalar şişme testi)
Eozin-Y Vitalite Testi
İmmotil spermatozoa sayısının %50’den fazla olması durumunda canlı spermatozoa sayısını saptamak amacıyla özel boyama teknikleri uygulanır. Bu testin temeli, ölü spermatozoaların membran yapısı da bozulacağından, boyaları içlerine almasına dayanmaktadır.
Işık mikroskopu veya fazkontrast mikroskop altında 100 hücre sayılarak, canlı (boya almamış) ve ölü (boyanmış) spermatozoalar kaydedilir. Bu şekilde immotil olan spermatozoaların canlı ya da ölü olup olmadıkları anlaşılabilir. Test aynı zamanda spermiyogramın motilite değerlendirmesini kontrol da etmiş olur, çünkü ölü hücre sayısı immotil hücre sayısını aşmamalıdır. Hareketsiz olup boya almayan, yani canlı olan spermatozoalarda kuyruk defekti bulunduğu düşünülür ve bu hastalar ICSI için uygun adaylardır.
Teknik
Önce Eosin-Y solüsyonu hazırlanır. Bunun için Eosin-Y’nin % 0.9 (9 g/l) sodyum klorid solüsyonu içerisinde %0.5 (5 g/l) ‘lik solüsyonu hazırlanır. Yada, bu amaçla hazırlanmış hazır solüsyonlar da temin edilerek kullanılabilir.
Bir mikroskop lamı üzerine 1 damla (10-15 mikrolitre) taze semen ve 1 damla %0.5 Eosin solüsyonu konularak karıştırılır ve lamel ile kapatılır.
Bir veya iki dakika sonra 400X büyütmede, ışık mikroskopu yada fazkontrast mikroskop altında incelenir. Boya almamış (canlı) ve boyanmış (ölü) hücreler sayılır.
Eosin-Nigrosin Boyası ile Vitalite Testi
Distile su içerisinde %1 (10 g/l) Eosin-Y solüsyonu ve distile su içerisinde %10 (100 g/l) Nigrosin solüsyonları hazırlanır.
Bir damla semen 2 damla %1 Eosin-Y ile bir tüp içerisinde karıştırılır.
30 saniye sonra 3 damla %10 Nigrosin eklenir, ve karıştırılır.
Karışımdan 1 damla alınarak lam üzerinde yayma yapılır. Havada kurumaya bırakılır. Daha sonra mikroskop altında incelenir.
Bu yöntem ile hazırlanan preparatların saklanılarak daha sonra tekrar bakılarak incelenme olanağı vardır.
HOS Testi (Hipoozmolar ortamda şişme test)
Basit bir test olup, sağlam hücre membranının semi-permeabilitesi nedeniyle hipoozmolar bir ortama konulduğu zaman spermatozoa’nın içine su alarak şişmesi esasına dayanmaktadır. Spermatozoanın fonksiyonuna yönelik bir test olarak kullanılmayıp, ek bir inceleme yöntemi olarak kabul edilmelidir. Yapımı ve skorlaması kolay olup, sperm kuyruğunun hücre membranının bütünlüğü ve kompliansı hakkında bilgi verir. Normalde %50’nin üzerinde spermatozoanın pozitif sonuç vermesi gerekir.
Tekniği
HOS solüsyonunu hazırlamak için 100 ml distile su içerisinde 0.735 g sodyum sitrat (Na3C6H5O7.2H2O) ve 1.351 g früktoz karıştırılır. Parçalara ayrılarak, -20oC’da saklanılır. Kullanılacağı zaman eritilir ve iyice karıştırılır.
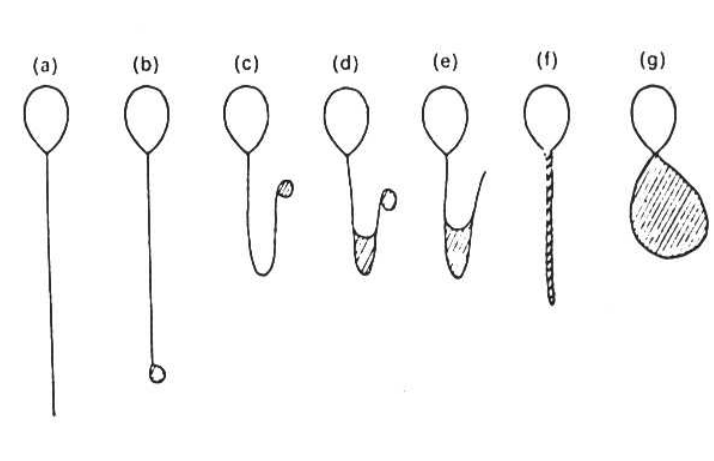
Test yapılırken, 1 ml HOS solüsyonu ağzı kapaklı Eppendorf tüpü içerisinde 37oC’da 5 dk ısıtılır. 0.1 ml likefiye olmuş semen eklenir. En az 30 dk süreyle (120 dk’yı geçmeyecek şekilde) 37oC’da bekletilir. Daha sonra bir damla alınarak lam üzerine konulur ve fazkontrast mikroskopu altında incelenir. Kuyruğun şekline bakılarak, şişme durumu değerlendirilir. 100 spermatozoa sayılır.
Şekilde HOS testi sonucu değişik şekiller almış kuyruk örnekleri görülmekte. (a) normal, (b-g) değişik şekiller. Şişme gösteren kuyruk kısımları içleri çizilerek belirtilmiştir.
Sperm konsantrasyonu tayini
Spermatozoa sayımını 2 metodla yapmak mümkündür: Neubauer hemositometresi ve Makler kamarası. Neaubauer kan sayma lamı üzerine sperm sulandırıldıktan sonra konularak sayım yapılır. Makler’de ise sulandırmaya gerek yoktur. Neaubauer için likefiye olan sperm örneği bir lökosit pipetine 0.5 işaretine kadar çekilir. Üzerine 11 işaretine kadar %5 NaHCO3 + %1 formalin karışımı eklenir ve iyice karıştırılır. Bu şekilde 1/20 oranında bir dilüsyon olur. Anlatıldığı şekilde yapılması durumunda 50 mikrolitre semen 950 mikrolitre dilüsyon solüsyonu ile karıştırılmış olmaktadır. Dilüsyon solüsyonunun hazırlanması için ise 50 g sodyumbikarbonat (NaHCO3) 10 ml’lik %35 formalin ile (v/v) karıştırılarak, son volüm 1000 ml’ye tamamlanır. Kullanılan karışım spermleri immobilize edeceği için de sayımı kolay olmaktadır.
Sulandırma işlemini takiben ilk birkaç damla dışarı atılır ve arkasından Neaubauer lamının iki kanalı içine birer damla (10-20 mikrolitre) bırakılır, üzeri lamel ile kapatılır. 2 dakika stabilizasyonu için beklenildikten sonra sayıma geçilir. Her biri 16 küçük kare içeren 5 büyük kare içindeki hücreler sayılır. Sulandırma oranına göre mililitredeki hücre sayısı hesaplanır. 1/20 dilüsyon için 5 büyük kare içindeki hücre sayısı bir milyon ile çarpılır. 1/10 sulandırmada önce ikiye bölünüp sonra bir milyon ile çarpılır. Eğer tüm büyük kareler sayıldıysa bulunan toplam hücre sayısı 1/20 dilüsyon kullanıldıysa, sadece 200 000 ile çarpılacaktır. İki sayım arasında &20’den fazla fark varsa sayım tekrarlanmalıdır. Sperm konsantrasyonu 20 milyon/ml’den az olan olgularda daha az sulandırma yapılmalıdır.
Makler metodunda ise bu amaç için özel olarak dizayn edilmiş bir sayım kamarası kullanılır. Bu kamaranın lam ve lameli arasında 10 mikron3’lük sabit bir hacim bulunmaktadır (10 mikrometre derinlikte). Yüzeyinde ise 0.1mm X 0.1mm boyutlarında 100 kareden oluşan bir ağ içerir. Ejakulat likefiye olduktan sonra ve diğer mikroskopik incelemeleri yapıldıktan sonra 50oC’da 3 dk ısıtılarak spermatozoaların immobilize olmaları sağlanılır. 1 damla sperm Makler kamarasının ortasına yerleştirilir ve üzeri lameli ile kapatılır. X20 büyütmede incelenir. 10 küçük kare içerisindeki hücre sayısı sayılarak 1 milyon ile çarpılır. Bu sayı 1 mililitredeki hücre sayısını verir.
Sperm morfoloji analizi
Antisperm antikor tayini (IBD, MAR testleri)
Spermatozoaların yüzeyini kaplayan antisperm-antikorların varlığı immünolojik infertilite için spesifik olarak kabul edilir. Semen içindeki sperm antikorlaraı genelde iki çeşittir: IgA ve IgG. IgA’nın klinik önemi IgG’den daha fazladır. IgM, molekül büyüklüğü nedeniyle semende görülmez.
Antikorların saptanması taze ejakulatta IBT ve MAR testleri ile yapılır.
Bu testlerin yapılabilmesi için sperm sayımında ileri hareketli en az 100 spermatozoanın bulunması gerekir. Ejakulatta fazla mukus bulunması test sonuçlarını olumsuz etkileyebilir. IBT ve MAR testi sonuçları her zaman korale olmayabilir. IBT, sperm aglütinasyon ve immobilizasyon testleri ile daha uyumlu sonuçlar vermektedir. Bu testlerin pozitif bulunması halinde sperm-servikal mukus kontakt testi yada sperm-servikal mukus kapiller tüp testleri ile serumda antikor titrasyonu testleri de tanıyı teyid etmek için yapılabilir.
Immunobead Test (IBT)
IBT testi ile sperm yüzeyine yapışık antikorlar saptanabilirler. Immunobead partikülleri tavşan anti-immünglobülünlerine bağlı polyacrylamide taneciklerdir. Testin yapılışı için, öncelikle ejakulat sperm yıkama mediumu ile karıştırılarak santrifüj edilerek birkaç kez yıkanır. Daha sonra sperm süspansiyonu immünobead süspansiyonu ile karıştırılır. 400 x büyütmede faz kontrast mikroskop altında incelenir. Spermatozoa süspansiyon içinde yüzdükçe immunobead + anti-immünglobulin partikülleri yüzeyinde antikor bulunan spermlere yapışırlar. Yüzeyine immunobead bağlı sperm oranı hesaplanır. Ayrı ayrı immunglobülinler kullanılarak, IgG, A ve M için test tekrarlanır. Ancak, her üç grup antikoru total olarak saptamak amacıyla ( total B-hücre bağlanması) one-step test de geliştirilmiştir.
%20 veya daha fazla motil spermatozoanın parçacıklara bağlanmış olması durumunda test pozitif kabul edilir. Ancak, servikal mukus içinde sperm penetrasyonu ve in vitro fertilizasyon %50 veya daha fazla motil spermatozoanın antikor bağlı olması durumunda anlamlı derecede bozulmaktadır. Bu nedenle, immunobead testinin anlamlı olarak bozuk kabul edilmesi için en az %50 spermatozoanın antikor tutulumu göstermesi gerekir. Sperm kuyruğuna bağlı antikorların fertilizasyon üzerine olumsuz etkileri bulunmamaktadır.
Mixed antiglobulin reaction test (MAR test)
Taze spermin immünglobülin bağlanmış latex partikülleri yada koyun eritrositleri ile karıştırılmasıyla yapılır. Bu karışıma ayrıca monospesifik anti immünglobülin (IgG veya IgA) eklenir. Partiküller ile motil spermatozoaların aglütinasyon oluşturması durumunda test pozitif kabul edilir. %50 veya daha fazla motil spermatozoanın partiküllere bağlanmış olması, immünolojik infertilite tanısı koydurur. %10 ile %50 arasındaki bağlanmalar şüpheli immünolojik etyoloji olarak kabul edilir.
Opsiyonal testler
Semen kültürü
Kültür için ejakulat toplanmasında kontaminasyonu önlemek için özen gösterilmelidir. Sperm çıkarılmadan önce idrar yapılmalı. Hemen arkasından el ve penis sabun ile yıkanıp, iyice durulanıp kurulanmalıdır. Sperm steril bir kap içine toplanarak mikrobiyoloji laboratuvarına teslim edilir. Genital bezlere ait enfeksiyon varlığını ortaya koymak için hem aerobik hem de anaerobik kültürler yapılmalıdır.
Aerobik bakteri kültürleri kanlı agar içinde yapılır. Eğer bakteri konsantrasyonu 1000 koloni /ml’yi geçerse, koloni tipi tayin edilir. Koloni uniform görünümdeyse, tiplendirme ve antibiyogram yapılabilir. Ama koloni görünümü heterojenik ise kontaminasyon bulunabileceği düşünülerek yeniden semen toplanmalı ve test tekrarlanmalıdır.
Eğer bakteri konsantrasyonu 1000 koloni/ml’den az ise aerobik bakteri varlığı bakımından test negatif kabul edilebilir. Genital enfeksiyon araştırması için ayrı özel mikrobiyoloji laboratuvarının bulunması gerekir.
Aşağıdaki spesifik markır miktarlarının düşük bulunması, o glandın fonksiyonunda bir bozukluğa işaret eder. Özellikle enfeksiyonun varlığı sekresyon fonksiyonlarında azalmaya yol açabilir. Eğer enfeksiyon tedavisinden sonra bir düzelme olmuyorsa kalıcı bozukluk yerleşmiş demektir. Enfeksiyonun bulunması mutlaka markırlarda bir bozulma yapacaktır anlamına gelmez.
Prostat için çinko ve sitrik asit
Seminal veziküller için früktoz, düşük pH, volüm azlığı, koagülasyon olmaması, koku tetkiki
Epididm için L-karnitin, nötral (daha spesifiktir) ve asidik alfa-glükozidaz, gliserofosfokolin
İmmatür germ hücrelerinin analizi
Ejakulatta immatür germ hücrelerinin bulunması spermatogenez bozukluğunu gösterir. Ayrıca, germ hücrelerinin mayotik kromozomları çalışılarak kromozomal bozukluklar tanınabilir.
Araştırma amaçlı testler
Spermatozoa fonksiyonları için serbest oksijen radikalleri, kreatin fosfokinaz bakılabilir. Bunların artmış olması patolojiktir. Özellikle spermatozoa orta parça defektlerindeki anormalliklerle birlikte görülür.
Zonası çıkarılmış hamster oosit testi
İnsan zona pellusida bağlanma testi
Akrozom reaksiyonu skorlaması
Kompüterize sperm analizi
Özellikle sperm motilitesinin satndardize edilmiş doğru ve detaylı analizi için kullanılır. Spermatozoaya ait zamana bağlı kinetik parametrelerinin hesaplanması esasına dayanır. Mikroskop ile irtibatlandırılmış bir videokamera kullanılır. Kompüterize analiz teknolojisi henüz tüm dünyaca kabul edilmiş rutin bir uygulama haline gelmemiştir. Bununla birlikte, sperm hareketlerinin değerlendirilmesinde göz ile değerlendirmeye göre daha kesin değerler verir.
Sıklıkla sperm hareket özellikleri içn kullanılırsa da, sperm konsantrasyonu ve morfoloji değerlendirmesinde de faydalanılabilir.
Amaç
- Prostaglandin ve diğer inhibitör maddelerin spermden uzaklaştırılması
- İleri-motil spermatozoaların konsantre edilerek toplanması
- Spermatozoaların motilite ve ileri hareketlerini artırmak
- Seminal plazma volümünü, uterusa verilebilecek miktara kadar azaltmak
Sıklıkla kullanılan yöntemler
- Swim-up (yüzdürme) tekniği
- Standart yıkama yöntemi (santrifüj ve yüzdürme)
- Gradient tekniği
- Mini-gradient yöntemi
Swim-up (yüzdürme) yöntemi: Tüm ejakulat 0.5-1 ml’lik fraksiyonlar halinda ayrı ayrı konik tüplere konulur (Falcon tüpler, 15 ml’lik). Üzerlerine 2 ml sperm yıkama mediumu eklenir. Tüpler 37oC’da 1-2 saat süreyle %5 karbondioksitli ortamda 45o eğimli pozisyonda inkübe edilir. İnkübasyon sonunda üstteki 1ml’lik kısım pipetle alınarak kullanılır. Bu yöntemin sakıncası, ileri derecede oligozoospermi ya da astenozoospermi olgularında yeteri kadar sperm elde edilememesidir.
Standart yıkama yöntemi (santrifüj ve yüzdürme): Likefiye olmuş semen konik bir tüp içerisinde 1 : 1-2 volüm oranında sperm yıkama mediumu ile karıştırılır. 200-300 x g’de, 10-15 dakika santrifüj edilir. Üstteki supernatant kısmı atılarak, dipte kalan pellet 0.5 ml medium ile tekrar karıştırılarak kullanılabilir. Bu işlem 2 kez tekrarlanabilir ya da ileri derecede oligozoospermi olgularında sadece 1 kez yapılarak bırakılır. İstenilen olgularda, alttaki pellet kısmının üzerine 1-2 ml medium konularak, 37oC’da 1-2 saat süreyle %5 CO2 ortamında inkübe edilir ve daha sonra üstteki 1 ml kısım pipet yardımıyla alınarak kullanılır. Bu şekilde daha fazla sayıda motilitesi iyi sperm elde edilmiş olunur.
Gradient tekniği: Burada silica partiküller içeren gradient mediumlar kullanılır. 15 ml’lik konik Falcon tüpü içerisine, aşağıdan yukarıya doğru her birinden 1 ml olacak şekilde %90, %70 ve %50’lik gradient solüsyonları üst üste konularak 3 tabakalı yıkama yapılabilir veya sadece 2-3 ml %80 ve 2-3 ml %40’lık iki tabaka ile hazırlanmış yıkama da kullanılabilir. En üstteki tabakanın üzerine, her bir gradient tabakası için 1 ml olacak şekilde, 2-3 ml likefiye olmuş ejakulat sarsmadan bırakılır. 200-500 x g’de 10-20 dakika santrifüj edilir. Daha sonra, en alttaki fraksiyon (kullanılan gradient miktarına göre 1 yada 2-3 ml) geride bırakılarak üstteki supernatant kısmı bir pipetle aspire edilerek dışarı atılır. Dipte bırakılan kısım, 1 : 1 volüm medium ile karıştırılarak yukarıda tarif edildiği şekilde yıkanır (100 x g’de 10 dakika veya 500 x g’de 5 dakika olacak şekilde) ve altta toplanan pellet üzerine 0.5 ml medyum eklenilerek kullanılır.
Mini-gradient yöntemi: İleri derecede oligozoospermi olgularında bu yöntem modifiye edilerek uygulanmalıdır. Her bir gradient tabakasından 0.3 ml konulur. Burada kullanılacak sperm, önce 100 x g’de 10 dakika yıkanmalı ve bu şekilde volümü azaltılmalı, daha sonra gradient solüsyonlarının üzerine konulmalıdır. İşlemin diğer basamakları aynen uygulanır.
Gradient yöntemlerinde, spermler partiküllerin arasından aşağıya doğru yüzerek dipte toplanırlar. Ayrıca bu yöntemde, akrozom membranı üzerine olan mekanik etkinin de fertilizasyonu arttırıcı etkisi bulunduğu ileri sürülmektedir. İmmatür hücrelerin ve lökositlerin de ortamdan uzaklaştırılmaları, bunlardan açığa çıkabilecek serbest oksijen radikallerini azaltarak, fertilizasyonu düzeltiyor da olabilir. Bir diğer önemli husus ise santrifüj hızıdır. 200 x g’den fazla hızlar kullanılırsa, immotil spermler ve debrisler de dibe çökebileceklerinden, kaliteli sperm elde edilmesini önleyebileceği bildirilmişse de, 2 tabakalı gradient yönteminde 500 x g’nin kullanımı da önerilmektedir.
Gradient yönteminde gradient solüsyonları üzerine sperm konulduktan sonra uygulanacak santrifüjün süresi çok önemlidir. Öncelikle motil olan spermler dipte toplanacağından, sürenin uzaması halinde nonmotil hücreler ve debrisler de dipte birikeceklerdir. Genel olarak, normal sperm parametrelerinde 10-20 dakika, orta derecede bozulmuş olanlarda 10-30 dakika, ileri derecede bozuk sperm örneklerinde ise 15-45 dakika santrifüj edilmeleri önerilir. Viskozitesi artmış spermler, motilitesi %20’den az olan spermler ve hücre sayısı 20 milyon/ml’den fazla olan spermlerin de uzun süreli santrifüj edilmeleri gerekir. Normal morfoloji oranları düşük spermlerin ise daha kısa süreli santrifüj edilmeleri uygun olur.