Hazırlayan: Prof. Dr. Kaan AYDOS
Testisleri çalıştıran hormonlar beyinin hipofiz denilen bölgesinden salgılanır. Yaklaşık 100 yıl önce, hayvanlarda bu bölgenin çıkarılmasının testisleri küçülttüğü, çürüttüğü görüldükten sonra, beyinden salgılanan hormonların da sperm yapımında önemli olduğu anlaşıldı. Bunun üzerine çocuk sahibi olmak isteyen erkeklerde hormonlarla sperm yapımını uyarmak yolunda değişik tedaviler denenmeye başladı. Ama erkekte standart sperm değerleri çok değişkenlik gösterir. Örneğin aynı erkekte değişik zamanlarda sperm tahlili yapsak, azoospermi ile 200 milyon arasında değişen sayılarda sperm çıktığı bile görülebilir. Ayrıca, çocuk sahibi olan ve olamayan erkeklerin sperm değerleri arasında da anlamlı bir ilişki bulunmaz. Örneğin 1 milyon sperm çıkaran erkeğin çocuğu olurken, 50 milyon sperm bulunan bir diğeri yıllarca beklemesine karşın eşini gebe bırakamayabilir. Dolayısıyla sperme bakarak çocuk olma ya da tedaviden fayda görme şeklinde bir yorum yapmak da güçleşmekte.
Bu sakıncalardan kurtulmak için, erkekte çocuk olmasını engelleyen spesifik bir nedenin bulunması ve tedavinin de buna yönelik yapılması önem kazanmakta. Buna “hedefe yönelik tedavi” adını veriyoruz. Bu konuda en belirgin hedef, azoospermisi olan erkeklerde tedavi ile menide ya da testislerde sperm bulunmasıdır. Eğer tedavi sperm çıkmasına yarıyorsa, başarılı demektir, değilse faydasız kabul edilir.
Hormonların Sperm Yapımında Rolü
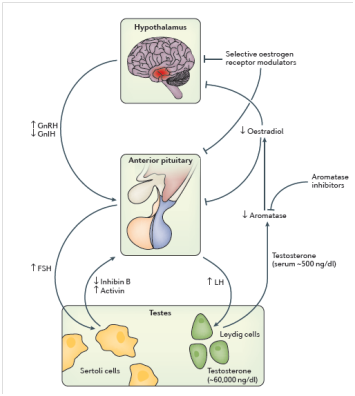
Şekil 1. Erkekte sperm üretiminden sorumlu hormon aksının işleyişinin şematik görünümü.
FSH ve LH
Erkekte beyinde hipotalamus denilen bölgeden, gonadotropin salgılatıcı faktör, yani GnRH adı verilen bir hormon salgılanır. Bu hormon yine beyinin bir diğer bölgesi olan hipofize ulaşarak; FSH ve LH adlı 2 hormonun yapılmasını uyarır. Aynı zamanda yine hipotalamustan salgılanan gonadotropin inhibe edici hormon (GnIH) tarafından da salgılanmaları baskılanır.
LH testislere ulaşarak Leydig hücrelerinden testosteron yapılmasını uyarırken, FSH yine testislerde Sertoli hücrelerine ulaşır ve sperm yapımını sağlar. Sağlıklı bir sperm yapımı işte bu 2 hormona yani testosteron ve FSH’ya bağımlıdır.
Gerçekten de, eğer FSH’nın yapısında bulunan FSH-beta ünitesi genetik olarak eksik kalmışsa, azoospermi gelişir. FSH hormonunun Sertoli hücrelerine girmesini sağlayan FSH-reseptörü de bozuksa, yine sperm üretimi aksayabilir. Benzer şekilde LH’nın yapısındaki beta ünitesi de bozuk üretilmişse, yine sperm yapımı bozulabilir. FSH ve LH hormonlarının yapısının genetik olarak araştırılması neticesi böyle bir eksiklik saptanırsa, tedavi ile sperm çıkışı sağlanabilir. Ancak bu konuda uygulamalar sınırlı sayıdadır.
İnhibin B
Bir de kanda İnhibin B adı verilen hormon bulunur. İnhibin B, FSH hormonunun uyarması ile Sertoli hücrelerinden salgılanır. Eğer Sertoli hücreleri bozuksa, inhibin B seviyesi düşer ve buna bağlı olarak da kanda FSH yükselir. Biz kanda inhibin B düzeyini ölçerek, Sertoli hücrelerinin, dolayısıyla sperm üretiminin normal ya da bozuk olduğunu anlayabiliriz. Ne kadar fazla düşmüşse, sperm üretimi de o derece fazla bozulmuş demektir. İnhibin B sperm üretimi hakkında FSH’ya göre daha güvenilir bilgi verir. Ancak inhibin B ölçümü klinik uygulamada rutine girmiş değildir.
Aktivin
Testislerde Sertoli hücrelerinden salgılana bir diğer hormon da Aktivindir. Aktivin ise hipofizden FSH salgılanmasını artırır. İnhibin B Aktivini baskılar, dolayısıyla Aktivin ne kadar yüksekse, inhibin B de o kadar düşük demektir, yani sperm üretimi o derece bozulmuştur. Netice olarak, FSH’nın yüksek, inhibin B’nin düşük ve Aktivinin yüksek gelmesi, sperm üretiminde ciddi bir bozulma olduğunun objektif göstergeleridir. Ama FSH dışındakilerin klinikte kullanılması çok yaygın değildir. FSH hormonunun normal değerleri 1.4 ile 18.1 IU/l olarak kabul edilir. Ancak 4.5’in üzerine çıkması, sperm üretiminin bozulduğunu gösterir.
Östradiol
Erkekte sperm üretiminin durumunu araştırmak için ölçülen bir diğer hormon östradiol’dür. Östradiol, testosterondan aromataz enzimi aracılığıyla yapılır. FSH ve LH’nın beyinden salgılanmasını baskılayıcı bir etkisi vardır. Dolayısıyla, eğer östradiol çok yükselmişse, bu hormonların salgılanmasını azaltarak sperm yapımını olumsuz etkileyebilir. Aksine, östradiol çok düşerse ya da reseptörü çalışmazsa ya epididimlerde ödem yaparak ya da başka mekanizmalarla sperm üretimini bozabilir. Netice olarak, östradiolün normal sınırlarda olması, sağlıklı bir sperm üretimi için gereklidir.
Hormona Bağlı Sperm Bozuklukları
Testislerde testosteronun az üretilmesi sperm yapımını bozar. Bunun 2 nedeni olabilir:
1) Beyinden LH’nın az salgılanması (hipogonadotropik hipogonadizm).
2) Testis bozukluğu ya da primer testiküler yetmezlik (hipergonadotropik hipogonadizm).
Hipogonadotropik hipogonadizm’de hem FSH ve LH hem de testosteron çok düşmüştür. Doğuştan olmuşsa, genellikle ergenliğe girme de gecikir. Penisin küçük kalması, testislerin yerinde olmaması ya da kemik zayıflığı gibi belirtilerle anlaşılır. Eğer koku almada bozukluk da eşlik ediyorsa buna Kallman Sendromu adı verilir. Çok nadirdir, yaklaşık 10 bin doğumda bir rastlanılır. KAL1, PROKR2 ve FGFR1 genlerinde mutasyon neticesi gelişir.
Bir de erişkin yaşlarda gelişen hipogonadotropik hipogonadizm vardır. Bunlarda hipofiz hastalığına bağlı olarak LH ve FSH yine düşmüştür ama doğuştan gelenlere göre biraz daha yüksek bulunur (FSH 1.5 IU/l, LH 2.9 IU/l). LH düştüğü için testislerde testosteron da az üretilir. Testosteron düşük olduğu için buna cevap olarak LH yükselmiştir ve bu da testosteronu fazla olmasa da bir miktar yükseltir. Neticede kanda LH normal ya da yüksek bulunsa da, testosteron yetmezliği vardır ve sperm üretimi bozulmuştur. Bu grup hastalara “gonadotropini normal olan hipogonadotropik hipogonadizm/hipoandrojenizm” adı verilir. Böyle erkeklerde kanda ferritin (demir) düzeyine bakılarak hemokromatoz hastalığı, TSH hormonuna bakılarak hipotirodizim, prolaktin bakılarak hipofiz adenomu araştırılmalı, gerekirse bunun için beyin MRI çekilmelidir. Ayrıca sickle-cell anemi (orak hücreli anemi) için genetik testler yapılmalı. Hipogonadotropik hipogonadizme yol açan nedenlerden birisi beyinde prolaktin hormonu salgılayan hipofiz bezinin tümörü olup, hastalarda görüş alanında daralma, göğüsten süt gelmesi ve cinsel güçte azalma şikâyetlerine neden olur. Eğer tümör 1 cm’den daha büyükse, yakınındaki FSH ve LH salgılayan bezlere de bası yaparak bu hormonların düşmesine yol açar. Eğer bu belirtiler yoksa, rutin muayenelerde prolaktin bakılması fazla fayda sağlamaz çünkü tüm infertil hastalar arasında bu hastalığın görülme sıklığı ancak %0.5-%33 arasındadır. Ama kanda prolaktin düzeyi 250 ng/ml’nin üzerine çıkmışsa, beyin filmleri çekilmesi önerilir.
Hipergonadotropik hipogonadizm; testislerin çalışma bozukluğundan kaynaklanır. Kan tahlilinde FSH ve LH’da yükselme görülürken testosteron normal ya da yükselmiş olabilir. Buna yol açan genetik nedenli hastalıkların başında Klinefelter Sendromu gelir. Bu hastalarda genetik inceleme yapıldığında fazladan bir X kromozomu bulunduğu görülür (47,XXY) ve muayenelerinde sıklıkla testisler küçük, memelerde jinekomasti denilen büyüme ve sperm tahlilinde de ileri derecede düşüklük bulunur. Klinefelterli erkeklerde sorun; i) testislerde Leydig hücrelerinde testosteron hormonu üretiminde azalma ve ii) CYP19A1 genindeki bozukluğa bağlı olarak aromataz enziminde yükselme neticesinde testosteron:östradiol oranında artıştır. Hipergonadotropik hipogonadizm bunun dışında kemoterapi alanlarda ya da inmemiş testis ve testis tümörü ile kendini gösteren testiküler disgenezis sendromunda da görülür. Bir diğer neden ise androjen duyarsızlığı durumu olup, şiddetine göre değişen derecelerde saç sakal, kıl, yağ, kas dokularında azalma ve sperm değerlerinde bozulma ile ortaya çıkar.
Testosteronun ölçülmesi
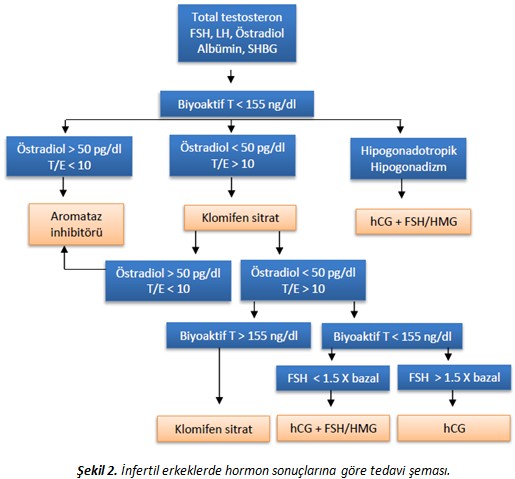
Bütün bu hormonal bozuklukların tanınmasında ilk hedef, testosteron düzeyinde düşüklüğün gösterilmesidir. Total testosteron sabah verilen kan örneklerinde normalde 280-300 ng/dl arasında olmalıdır. Ama 40 yaş altı erkeklerde pratikte 400 ng/dl’den daha düşük testosteron sonucu da androjen yetmezliği için eşik değer olarak kabul edilebilir. Oysa kanda testosteron her zaman serbest olarak bulunmaz, SHBG (seks hormon bağlayan globülin) ya da albümine bağlı halde taşınır. Bu nedenle de testosteron araştırılırken ya serbest testosteron ya da biyolojik aktif testosteron (yani serbest ve albümine bağlı testosteron toplamı; biyoaktif testoteron) formlarına bakılmalıdır. Dolayısıyla SHBG miktarını etkileyen diğer hastalıklarda da kanda testosteron düzeyi değişebilir örneğin karaciğer hastalıkları, tiroid hastalıkları ya da obezite gibi. Yaşlı erkeklerde de SHBG artarak kanda testosteronu düşürebilir.
Netice olarak çocuk olmaması nedeniyle gelen olgularda tanı koymak için önce total testosteronun ölçülmesi ve 400 ng/dl’nin altında gelmesi durumunda biyolojik aktif testosteron istenmesi, ya da doğrudan biyoaktif testosterona bakılması tercih edilebilir. Serbest testosteronun 0.23 nmol/l (6 ng/dl)’den ve biyolojik aktif testosteronun ise 5.3 nmol/l (153 ng/dl)’dan daha düşük gelmesi durumunda testosterona bağlı bir eksiklikten şüphelenilmelidir. Ancak total, serbest ya da biyoaktif testosteron ölçüm teknikleri çok da güvenilir değildir. Klinik bulgularla birlikte değerlendirilmesi doğru olur.
Testosteron düşüklüğü gayet kolay düzeltilebilir. Ama her zaman da çocuk olmasına mani bir durum teşkil etmez. Sperm değerleri normal olan erkeklerin üçte birinde de testosteron düşük gelebilir. Dolayısıyla, sperm değerlerinde bozulma ile kanda testosteron ölçüm sonuçları arasında her zaman tutarlılık olmayabilir. En tutarlı olduğu durum azoospermisi olan erkeklerdir. Azoospermik erkeklerin yarısına yakınında testosteron düşük gelir. Daha güvenilir bir parametre, testosteron:östradiol oranıdır. Bunun 10’un altında olması, testosteron eksikliğine bağlı infertilite için anlamlı bir göstergedir. Ancak şişman erkeklerde artmış aromatizasyona bağlı olarak da bu oran düşebilir.
Testosteronun Sperm Üretiminde Rolü
Aslında önemli olan, kandaki değil, testis içindeki testosteron seviyesidir. Testis içinde testosteron miktarı kandakine göre çok yüksektir; 60 bin ng/dl. Testislerde testosteron biyolojik aktif formda bulunur. Bunun kandaki biyoaktif testosteron ile çoğu kez bir ilişkisi de yoktur. Oysa kanda SHBG ölçerek testis içindeki SHBG miktarını tahmin etmek daha güvenilir sonuç verir. Ama bu da pratikte her zaman kullanılabilecek bir uygulama değildir. Yine de bazı merkezler, kanda total testosteron bakılmasının, testis içindeki total testosteron ile uyumlu sonuç verdiğini bildirmiştir. Gerçekten de, kanda total testosteronu düşük ve LH hormonu yüksek gelen erkeklerde testis boyutları da küçülmekte, testis içindeki testosteron düşüp, testosteron:östradiol oranı yükselmektedir. Hatta ilk kez mikroTESE yapılan ve sperm çıkmayan erkeklerde testis içinde testosterona bakılıp normal bulunduğunda hCG tedavisi yapılıp ikinci kez mikroTESE’ye alındıklarında, sadece testis içinde testosteronu yükselen erkeklerde sperm çıkabilmektedir. Dolayısıyla testis içinde testosteronu yükseltici bir tedavi verilmesi, TESE ile sperm bulma şansını da artırmakta. Gerçekten de testis içindeki testosteron düzeyi ile sperm bozukluğu arasında anlamlı bir ilişki vardır.
Kanda çok yükselmiş LH hormonunun testislerde Leydig hücrelerini aşırı uyarmasına bağlı olarak Leydig hücrelerinin fonksiyonu bozulabilir ve aynı zamanda sayıca da çoğalarak, asıl sperm üretimi yapan seminifer tubülleri baskılayıp normal çalışmalarını engelleyebilir. Bunlarda her ne kadar testis içinde testosterona bakılsa yüksek bulunabilir ama sperm üretimi bozulmuştur. En doğrusu testislerde testosteron:LH oranında düşüklüğün gösterilmesidir ama bunun ölçümü de klinikte mümkün olmaz. Böyle durumlar “Leydig hücre disfonksiyonu” olarak tanımlanmıştır. Bu durumun saptanmasında en duyarlı test, kanda INSL3 (insülin benzeri protein) proteininin ölçülmesidir. Bunun düşük bulunması, testis içinde testosteronun da düşük olduğunun en güvenilir göstergesidir. Ama ne yazık ki henüz pratik uygulamaya girmemiştir. Çünkü Leydig hücrelerinden salgılanan çok sayıda başka steroid yapısında protein de sperm yapımında rol alır.
Leydig hücresi dışında testislerde sperm üretiminden sorumlu bir diğer hücre grubu Sertoli hücreleridir. Bu hücrelerden salgılanan TGF alfa, TGF beta, EGF, FGF gibi proteinler sperm üretiminden sorumludur. Dolayısıyla hem Leydig hücreleri hem de Sertoli hücreleri ortak çalışarak sperm yapımını düzenlerler. Çünkü Sertoli hücreleri üzerinde, testosteronun bağlanacağı reseptörler bulunur (AR; androjen reseptörü). Ancak testosteronun sağlıklı biçimde bu reseptörleri uyarması durumunda sperm üretimi de başarıyla sürebilmekte. İşte, testis içinde testosteronun normalden düşük olması durumunda sperm üretiminin de bozulması bu nedenledir, yani ya testosteron yetersizliği ya da reseptör eksikliği neticesi Sertoli hücrelerinin yetersiz uyarılması. Androjen reseptörleri ise sadece FSH ile uyarıldığında artar, hCG tek başına böyle bir artış sağlayamaz. Bunun anlamı, tek başına hCG tedavisinin sperm yapımını düzeltmeye yetmeyeceği, yanı sıra FSH verilmesinin de gerektiğidir. Eğer testis dokusunu çıkarıp laboratuvarda testosteron ve FSH içeren bir ortamda bekletirsek, spermler normal gelişimlerini tamamlayabilirler. İleride bunları tüp bebekte kullanmak da mümkün olacaktır.
İnfertil Erkeklerde Hormon Tedavisi
Östrojen Reseptör Düzenleyicileri
Östrojen reseptör düzenleyicisi olarak bilinen en tanınmış ilaç klomifen sitrattır. Bu ilaç hipotalamusta östrojen reseptörlerini bloke eder. Bu da neticede hipofizden FSH ve LH’nın salgılanmasını artırır. Artan LH da testislerde testosteron yapımını uyarır. Bu ilaçlar hipofizde büyüme yaparak nadiren de olsa görme alanında bozulmalara yol açabilir. Ama geçici bir yan etkidir. Bazen kanda östrojeni de aşırı yükseltebilirler. Bu nedenle tedavi sırasında kan tahlilleri yakından takip edilmelidir. Çok nadir durumlarda tam ters etki yaratarak kanda testosteronu düşürüp, azoospermi yaptığı da görülmüştür. Östrojeni bloke etmesine rağmen kemik gelişimi üzerine ters bir etkisi bulunmaz, aksine kemik yoğunluğunu artırdığı gösterilmiştir.
Klomifen sitratın dozu, günaşırı 50 mg olarak önerilir. 2 ay devam edilmekle kanda testosteron, FSH ve LH anlamlı derecede yükselir. Devam dozu olarak her gün 25 mg kullanılabilir. En ideal hasta grubu genç erkekler, testislerin küçük ve LH’nın 6 IU/l’dan yüksek olmasıdır. Hipogonadotropik hipogonadik erkeklerin tedavisinde de başarıyla kullanılabilir. Etkili bir sonuç alınabilmesi için en az 3 ay tedaviye devam edilmelidir. Tedavi sırasında düzenli aralıklarla PSA ve tam kan sayımları yapılmalı.
Klomifen sitrat kullanımı için spesifik nedenler, FSH’nın ve testosteronun düşük olduğu hipogonadotropik hipogonadizm olguları ya da FSH ve LH’nın normal olduğu düşük testosteronlu olgulardır. FSH ve LH’nın yüksek olduğu olgular için genelde önerilmez.
Aromataz İnhibitörleri
Bu grupta letrozol (günde 2.5 mg) ve anastrazol (günde 1 mg) bulunur. Tedavide amaç, bozulmuş olan testosteron:östrojen dengesini düzeltmektir. Bu oranın 10’un altında bulunduğu azoospermili ya da ileri derecede sperm değerleri bozulmuş erkeklerde 6 ay tedavi sonrasında anlamlı bir düzelme elde edilmiştir. Genel olarak değerlendirildiğinde, infertil erkeklerde testosteron:östrojen oranı 10’un altına inmişse, aromataz inhibitörleri ile tedavinin spesifik endikasyonu bulunmaktadır.
Gonadotropin Tedavisi
Bu grupta 3 çeşit ilaç bulunur: idrardan elde edilenler, saflaştırılmış olanlar ve rekombinan teknoloji ile üretilenler. Erkekte kullanımları bakımından, bazı özel durumlar dışında aralarında anlamlı bir fark yoktur.
FSH içeren ilaçlar uzun yıllardır erkek infertilitesinin tedavisinde başarıyla kullanılmıştır. Ama tedaviye başlamadan önce bu hormonların kanda normal ya da düşük düzeylerde bulunmuş olması önemlidir. Çoğu metaanaliz de bunu destekler niteliktedir. FSH, hCG ile kombine de kullanılabilir. Testis biyopsilerinde ileri evrede maturasyon duraklaması görülen erkeklerde etkisi daha belirgindir. Genel olarak değerlendirildiğinde gonadotropin tedavisi verilmesi için endikasyon; FSH’nın normal olması ve ileri evrede bir maturasyon bozukluğu bulunmasıdır (geç maturasyon arresti veya hipospermatogenez). Ama gonadotropin tedavisinin asıl etkili olduğu grup, azoospermi olan hipogondotropik hipogonadizm olgularıdır; yani FSH, LH ve testosteronun her üçünün de düştüğü durumlar. İzole FSH ya da LH düşüklüğü dışında, FSH ve hCG birlikte kullanılır. 6 ay devam etmekle hastaların %75-94’ünde spermatogenez başlatılabilir. Ama bir kez spermatogenez başladıysa, tek başına hCG ile 1 yıl boyunca yeterli sperm çıkışı sürdürülebilir. Olguların %10’unda, tedaviyi kestikten sonra da normal sperm çıkışı devam edebilir. Tedaviye yeterli cevap alınamayacak hastalar; inmemiş testis olguları ile testis volümünün çok küçük olduğu (<4ml) erkeklerdir.
FSH ve LH’nın normal olduğu erkeklerde de hormon tedavisi etkili olabilmekte. Ancak bu tedaviden sonuç alınacak hasta gruplarının seçimi konusunda belli bir standart getirilememiştir.
Uzun süre dışarıdan testosteron ya da östrojen almış erkeklerde de sperm üretimi ciddi derecede bozulur. Bunlarda bu ilaçları kestikten ancak 6 ay sonra sperm üretimi yeniden başlayabilir, hatta bu yıllar da alabilir. Gerekirse FSH, hCG ve östrojen reseptör düzenleyicileri de kullanılabilir.
Azoospermide Hormon Tedavisi
Tıkanıklığa bağlı olmayan, testosteronu düşük gelmiş azoospermik erkeklerde hormon tedavisi yaygın olarak kullanılmaktadır. Ama sonuçları konusunda kanıtlanmış kesin bir veri bulunmamakta. Klinefelter hastalarında aromataz inhibitörleri tek başına ya da testosteron ile birlikte kullanıldığında, eğer kanda testosteron yükselmişse, yüz güldürücü sonuç alınabilir. İlk mikroTESE ile sperm çıkmamış olan erkeklerde de hCG tedavisi ile beşte birinde ikinci TESE ile sperm bulunabilmekte. Bu erkeklerde tedaviye yüksek doz hCG ile başlanılmakta (haftada 3 kez 5000 IU, 3 ay süreyle), FSH düştüğü zaman dışarıdan FSH da verilmektedir. Böyle tedavilerde dikkat edilmesi gereken en önemli husus yakın FSH takibi yapılmasıdır. Çünkü eğer FSH düşerse, mutlaka dışarıdan FSH eklenmesi gerekir. Diğer yandan, yine azoospermik erkeklerde 5 aylık klomifen sitrat tedavisi ile ya menide sperm çıkmakta ya da TESE ile sperm bulunabilmektedir. Testis biyopsilerinde erken evre maturasyon arresti olan erkekler tedaviye iyi cevap vermezler. Klomifen sitrat ile FSH’da %50’nin üzerinde bir yükselme elde edilemezse, tedaviye HMG/FSH iğnelerinin eklenmesi, sperm çıkış oranlarını artırabilir. Biz de bir grup azoospermik olguda FSH tedavisi kullandık ve 3 ay sonra yapılan TESE’lerde sperm elde etme başarısının 2 kat arttığını gösterdik. Özellikle testis biyopsisi hipospermatogenez gelenlerde bu tedavi daha başarılı olmaktaydı. Başka çalışmalarda da, ilk TESE ile sperm çıkmayan azoospermik erkeklerde biyopsisi geç evre maturasyon arresti gelmişse, %19’unda ikinci TESE’de sperm çıkacağı gösterilmiştir.
Bütün bu çalışmalar göstermektedir ki, seçilmiş azoospermik erkeklerde hormon tedavisi sperm çıkma oranlarını yükseltmektedir. Belki klomifen sitrat stimülasyon testi bu konuda yardımcı olabilir ama bunun pratikte kullanımı yaygın değildir.
Sonuç
Testislerde sperm aramanın yanı sıra hormon tedavisi eklenmesi, erkek faktörü infertilite tedavisinde umut verici bir yaklaşım olma yolundadır. Ancak sperm üretiminde genetik faktörler önemli bir etkendir. Diğer yandan, böyle tedavilerin takibinde elimizdeki en önemli gösterge olan sperm tahlili, fertilite potansiyeli için iyi bir gösterge de değildir. Tek kabul edilebilir gösterge, azoospermi olmasıdır. Yine de uygun hasta seçim kriterlerinin kullanılması ile spesifik bir temele dayandırılan hormon tedavileri, infertil erkeklerin baba olabilmelerinde kabul edilebilir bir yere sahiptir.
Kaynak:
*Kathrins M, and Niederberger C. Diagnosis and treatment of infertility related male hormonal dysfunction. Nature Reviews Urology. doi:10.1038/nrurol.2016.62, 2016
Biyolojik aktif testosteron hesaplaması için:
https://www.nebido.com/tools/index.php/en/default/index/free-calculator