Dr. Kaan AYDOS
Azoospermi ve azoospermik hastanın değerlendirilmesi
İnfertil çiftlerin yaklaşık %2’sinde azoospermi bulunmaktadır (Hull MGR, et al: Br Med J 1985; 291: 1693). Erkek populasyonu bakımından hesaplandığında ise infertilite yakınması olan erkeklerin %8’inde azoosperminin söz konusu olduğu anlaşılmaktadır. Araştırma sonuçlarına göre her 200 erkeğin biri azoospermi göstermektedir. Vazektomi yapılanları da buna eklersek oldukça büyük bir populasyonun azoospermi problemi ile karşı karşıya kaldığı anlaşılır.
Azoospermi obstrüktif ya da nonobstrüktif olabilir. Vazektomi, konjenital vaz deferenes yokluğu, hidrosel veya herni operasyonları sırasında veya kazalara bağlı olarak vaz ya da epididimlerin travması, ya da epididim enfeksiyonları obstrüktif tipte azoospermi nedenleri arasında sık rastlanılırlar. Bunların testislerinde spermatogenez normal olarak devam etmektedir. ICSI döneminden önce konjenital vaz agenezi olguları dışındakiler rekonstrüktif cerrahi ile tedavi edilmeye çalışılmaktaydılar. ICSI’nin uygulanım alanına girmesini takiben rekonstrüktif girişimlerde başarılı olunamayan olgular ve konjenital vaz agenezi olguları artık bu yeni teknikten faydalanarak çocuk sahibi olabilir hale gelmişlerdir. Gerçektende, obstrüktif azoospermisi olan her erkek ICSI sayesinde kendi genetik materyalinden çocuk sahibi olma şansına sahiptirler.
Azoosperminin obstrüktif mi yoksa nonobstrüktif mi olduğunun tanısı kolay olmakla birlikte, çok dikkatli yapılmalıdır. Aksi takdirde, nonobstrüktif bir olguda başarısızlıkla sonuçlanacak bir vazoepididimostomi operasyonu gereksiz yere yapılmış olunur. Obstrüktif azoospermi olgularının tedavi algoritmi oldukça farklıdır. Birkaç basit esası iyi değerlendirirsek böyle bir güçlükle karşılaşmamış oluruz ve neticede de kesin bir preoperatif tanı koyabiliriz. Eğer hastanın testis biyopsisi normal ise ve sperm analizinde azoospermisi varsa, bu olgunun obstrüksiyona bağlı azoospermisi bulunduğu açıktır. Bir de vaz deferensleri palpe edilebiliyorsa, bu hastanın rekonstrüktif cerrahiden fayda görebileceğine de karar vermiş oluruz. Böyle bir olguda diğer verileri elde etmeye çalışmanın gereği yoktur.
Serum FSH düzeyinin normal olması her zaman spermatogenezin normal olduğunu ya da obstrüksiyonun varlığını göstermez. Sadece, maturasyon duraklaması bulunduğuna ve nonobstrüktif tipte bir azoosperminin söz konusu olduğuna işaret eder. Serum FSH değeri aslında total spermatogonium sayısı ile ilişkili olup, matür spermatid sayısı ya da ejakulattaki spermatozoa konsantrasyonu ile yakın bir korelasyon vermez (DeKretser DM, et al: J Clin Endocrinol Metab 1974; 38: 787). Azoospermisi olan ama serum FSH’sı normal bir erkekte en sık tanı maturasyon arrestidir, obstrüksiyon değil. Böyle olgularda testislerde total spermatogonium sayısı normal olduğu için FSH da normal sınırlar içerisinde gelmektedir. Gerçekten de, FSH’nın yükselmiş olması Sertoli cell only (SCO) sendromu ile birlikte bozulmuş spermatogeneze işaret eder. Oysa bu da her zaman kabul edilmesi gereken bir kural değildir. Bütün bunlar göz önüne alındığında, sadece hormonal değerlendirimin obstrüksiyonun tanısında fazla anlamlı olmadığı anlaşılmaktadır.
Vazografinin yeri sadece obstrüksiyonun düzeltilmesine yönelik cerrahi girişimlerin bir parçası olarak düşünülmelidir. Tanı koymak ya da cerrahi bir uygulamaya gerek var mı diye değerlendirmek amacıyla yapılmamalıdır. Tek başına bir tanı aracı olarak vazografi yapılması bir çok bakımdan sakıncalıdır. Birincisi, vaz deferenslerin varlığını anlamak için skrotal eksplorasyon gerekmez, fizik muayene bunda yeterlidir. İkincisi, mikrocerrahi teknik kullanmaksızın vazografi yapmak amacıyla vazın kesilmesinin kendisi de obstrüksiyon yaratabilir. Üçüncüsü, preoperatif değerlendirimde vazogram verilerine gerek yoktur. Esas önemlisi, vazografi epididimlerin durumu hakkında hiç bilgi vermez ve obstrüksiyon için yanlış-pozitif ve nonobstrüksiyon için yanlış-negatif karar verilmesine yol açabilir. Eğer testis biyopsisi ve spermiyogram bulgularına dayanarak obstrüksiyon tanısı konmuş ise, vazografi yapılmasının tek mantığı vazoepididimostomi yapmak için vazın kesildiği zamandır. Böylece ejakulatör kanallar ve prostatik uretra seviyesinde vazın açık olduğu anlaşılır. Daha tanı aşamasında bu veriyi edinmenin bir faydası yoktur.
Epididim ve testislerin palpasyonu ya da enfeksiyon hikayesinin olmaması da tek başlarına yanıltıcı olabilir. Testislerde normal sperm üretimi olsa da volümü küçük olabilir, ve hiç sperm üretmeyen testisler de (örneğin maturasyon aresti olguları) sıklıkla büyük bulunabilirler. Diğer yandan, epididimlerinde inflamasyona sekonder obstrüksiyon bulunan olguların yaklaşık yarısında anamnezde geçirilmiş klinik epididimit hikayesi bulunmamaktadır. Epididimlerde enfeksiyona bağlı bir obstrüksiyon varsa, bu olgularda subklinik geçirilmiş bir enfeksiyon sorumlu tutulmaktadır.
Tanısal amaçlı testis biyopsisinin önemi
Azoospermi olgularının araştırılmasında en sık baş vurulan girişim testislerden biyopsi alınmasıdır. Açık teknikle yapılabildiği gibi iğne biyopsileri de önerilmiştir. Ancak açık biyopsi ile yeteri sayıda seminifer tubül elde edilebilirken (her bir kesit alanında >20) iğne biyopsilerinde bu sayıya erişebilmek için çok miktarda biyopsileme yapılması gerekmektedir. Buda iğne biyopsisini travmatik bir yöntem haline getirir.
Biyopsinin kalitesi de önemlidir. Biyopsinin spermatogenezin normal olup olmadığı ve sonuçta obstrüksiyon tanısı koydurarak bir rekonstrüktif ameliyattan fayda görüp görmeyeceği konusunda bilgi vermesi gerekir. Diğer yandan TESE ile yeterli sperm elde edilme şansı konusunda da yeterli bilgi sağlamalıdır. Çoğu kez dikkatsizce alınan biyopsiler formalin ya da alkol içinde saklanmakta veya travmatize edilmekte ve neticede “dökülme ve disorganizasyon” gibi yorumu güç sonuçlar verilmesine yol açılmaktadır. Genellikle testis biyopsilerinin yorumu kantitatif esaslara göre yapılmadığı için, TESE bakımından yetersiz bilgi vermektedir (Silber SJ, et al: Hum Reprod. 1997).
İnsanda spermatogenez kinetiğinin ve normal histolojisinin iyi anlaşılması ile testis biyopsilerinin kantitatif değerlendiriminin önemi de ortaya çıkarmıştır (Heller CG, et al: Recent Prog Horm Res. 1964; 20: 545). Spermatogenezin hızı, üretilen sperm sayısı ister az ister çok olsun değişmez, sabittir. Yani, sperm yapımının azalması daima üretilen sperm sayısındaki azalmadan kaynaklanmaktadır, sperm yapım hızındaki azalmadan değil. Bu nedenle ejakulattaki günlük üretilen sperm sayısı testis biyopsisine bakılarak anlaşılabilir. Normal spermatogenezi olan veya oligozoospermili erkeklerde testis biyopsilerine bakılarak ejakulatlarındaki sperm sayısının tahmin edilebileceği ortaya konmuştur. Örneğin vaz deferenste darlık olan ve bu nedenle oligozoospermi bulunan bir erkekte aslında testislerinde spermatogenez normal devam etmektedir. O halde bir testis biyopsisinin, sperm sayısındaki azalmanın obstrüksiyona mı yoksa sperm üretimindeki bozukluğa mı bağlı olduğunu açıkça ortaya koyması gerekir.
Testis biyopsilerinin bilateral yapılması ve her bir taraf için en az 20 seminifer tubülü içine alması gerekir. Matür spermatidler (koyu, yoğun boyanan kromatini bulunan oval hücreler) ve büyük pakiten spermatositler en kolay tanınan hücrelerdir. Bu hücrelerin varlığı ile ejakulattaki sperm sayısı arasında anlamlı bir ilişki vardır. Her ne kadar bir biyopside spermatogoniumdan leptoten, zygoten, pakiten spermatositler ve erken spermatidlere kadar tüm spermatogenez basamakları gözlenmekteyse de, klinikte önemli olanı sayılan en az 20 seminifer tubülde tubül başına düşen ortalama matür spermatid sayısıdır (Silber SJ: Clin Obstet Gynecol. 2000; 43: 854).
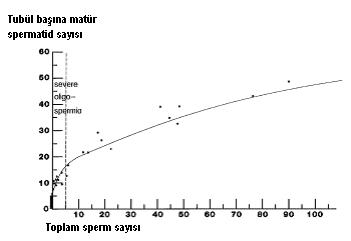
Tubül başına düşen matür spermatid sayısı ejakulattaki sperm sayısını tahmin etmede kullanılabilir. Tubül başına 40 matür spermatid varsa ejakulatta sperm sayısı 40 milyon/ml’nin üzerinde olmalıdır. Bu sayı 45 ise spermiyogramda 85 milyon/ml spermatozoa var demektir. Sperm sayısı < 3 milyon ise sadece 6-10 matür spermatid/seminifer tubül bulunuyor anlamına gelir. Bunun önemi obstrüksiyon kararı verirkendir. Genelde patoloji raporlarında, tubüllerdeki bol spermatosit ve az sayıdaki spermatide bakılarak normale yakın spermatogenez sonucu verilir. Oysa spermatid sayısı 3 ve altında ise ejakulata spermatozoa çıkması çok güçtür, bu olgularda vazoepididimostomi değil TESE/ICSI denenmelidir.
Seminifer tubüllerdeki ortalama matür spermatid sayısı ile ejakulatta çıkan spermatozoa sayısı arasında belirli bir ilişki vardır. Seminifer tubül başına düşen ortalama matür spermatid sayısı 3-6 arasındaysa ejakulatta da en azından bir spermatozoa görülür. 6-10 arasında spermatid varsa, ejakulattaki spermatozoa konsantrasyonu < 3 milyon/ml’dir, yani ileri derecede oligozoospermi (Silber SJ, et al: Hum Reprod 1997; 12: 2422’den alınmıştır).
Spermatogenezin durumunu göstermede serum FSH ölçümü her zaman uyumlu sonuçlar vermez. Azoospermisi maturasyon arestine bağlı olan erkeklerde serum FSH değeri normal bulunabilir. Serum FSH değeri asıl spermatogonium sayısı ve testis volümü ile daha uyumlu olup, matür sperm sayısı ile ilişkili değildir (DeKretser DM, et al: J Clin Endocrinol Metab. 1974; 38: 787).
Testiküler sperm ekstraksiyonu TESE
Yaklaşık 20 yıl öncesine kadar çocuk sahibi olabilmek ancak doğal yolla gerçekleşebiliyordu. Önceleri üremeye yardımcı teknikler (ÜYT) sadece donör spermi ile başarılı sonuçlar verirken, homolog sperm kullanıldığında başarı düşük kalmaktaydı. 1978’de insanda IVF ile ilk kez gebeliğin elde edilebilmesi ile bu alanda radikal değişiklikler başladı. Yine de infertil çiftlerin yaklaşık %40’ı sperm kalitesindeki bozukluk nedeniyle çocuk sahibi olamamaktadır. IVF ile başarılı olunamayan olgular içinse 1992’de Palermo tarafından insanda ilk kez uygulanan ICSI ile önemli oranda gebelik şansı doğmuş oldu. Çalışmalar ilerledikçe ICSI azoospermik olgularda da başarıyla kullanılmaya başlanıldı.
Obstrüktif azoospermide testislerden sperm elde edilebildiğinin gösterilmesinden hemen sonra, çok şiddetli spermatogenez bozukluğu bulunan nonobstrüktif azoospermili erkeklerde de testislerinden sperm elde edilebileceği anlaşıldı. Bunlardan alınan çok sayıdaki testis biyopsilerinde dağınık halde az sayıda odakta spermatogenezin devam ettiği ortaya kondu. Buradan elde edilen spermatozoalar ICSI’de kullanılarak sağlıklı gebelikler başarılmıştır.
| Histopatolojik tanı | Olgu sayısı (%) | Spermatozoa (+) olgu sayısı |
| Sertoli cell only sendromu | 36 (%23) | 9 (%25) |
| Fokal germinal aplazi | 32 (%21) | 9 (%29) |
| Maturasyon arresti | 32 (%21) | 10 (%32) |
| Hipospermatogenez | 53 (%35) | 27 (%51) |
| Toplam | 153 | 55 (%36) |
Primer testiküler yetmezlikli 153 olgunun tanısal testis biyopsi sonuçları ve mekanik yöntem ile yapılan mikro-TESE neticesi en az bir spermatozoa bulunan olgu sayılarının karşılaştırması (Aydos K: Klinik Bilimler 2001; 7: 636).
Ejakulatta buluna spermatozoa sayısı, testiste seminifer tubül başına düşen matür spermatid sayısı ile direkt ilişkilidir. Gerçektende, yeteri kadar tubül sayılıp, bunlardaki spermatid konsantrasyonunun hesaplanması bize ejakulattaki spermatozoa sayısını tahmin ettirebilir niteliktedir. Diğer yandan, komplet azoospermisi bulunan çoğu olguda testis histolojileri incelendiğinde birkaç adet spermatid içerdiği gösterilmiştir. Kantitatif olarak spermatogenezin değerlendirildiği bu çalışmalar, Sertoli cell only sendromu ya da maturasyon aresti gibi azoospermiye yol açan patolojilerde ICSI’de kullanılmak üzere testislerden sperm ekstraksiyonu yapılması gayretlerini daha da arttırmıştır.
Testislerde sperm üretiminin kantitatif olarak ileri derecede azalmış olduğu olgularda ejakulatlarında hiç spermatozoa bulunmasa bile, yine de testislerinde az da olsa sperm üretiminin gerçekleştiği bazı odaklar bulunabilir. Bu amaçla, ejakulatta sperm çıkması için gereken “sperm üretim eşiği” kavramı tanımlanmıştır. Şiddetli oligozoospermi olguları da aslında azoosperminin kantitatif olarak bir varyantıdır. Çünkü, azoospermi olgularında da %60’ında çok küçük odaklarda sperm üretimi devam edebilmektedir.Ancak sperm üretim miktarı “sperm üretim eşiği”nin altında kaldığı için ejakulatta sperm çıkmasına yetmemektedir.
TESE işlemi başlangıçta sperm bulunana kadar testislerden çok sayıda randomize biyopsiler alınarak yapılmaya başlanmıştır. Bu durumda bazı zorluklarla karşılaşılmaktadır. Öncelikle, %55-60 sperm bulma şansı olan bu uygulamada IVF-ICSI için hazırlanan çifte sonuç hakkında kesin konuşulamamaktadır. Diğer yandan, hangi erkekte başarılı olunabileceği ve hangisinde olunamayacağı konusunda da kesin bir karar verilememektedir. Çoklu biyopsilemenin yapıldığı bu teknik neticesinde hasarlanan testislerden bir sonraki denemede yeniden sperm bulunamaması olasılığı da söz konusudur.
Burada önemli olan iki konu üzerinde son yıllarda yoğun araştırmalar yapılmıştır: 1) tanısal testis biyopsisinin TESE sırasında matür spermatozoa bulma şansını belirlemede önemi; ve 2) testislerdeki travmayı minimalize edici mikrocerrahi tekniklerin kullanılması. Genel olarak değerlendirildiğinde daha önce alınmış bir biyopsinin daha sonraki TESE işleminde sperm bulunması şansını belirlemedeki doğruluğu en iyi olasılıkla yaklaşık %85’dir. Geri kalan %15 olguda testis biyopsisi yetersiz kalmaktadır. Ancak mikrocerrahi TESE tekniği ile sperm elde etme oranları daha da artmıştır.
Daha önce de belirtildiği gibi, nonobstrüktif azoospermi bulunan bir erkekte TESE ile hiç hücre bulunamayacağı sanılırken, bir kısmında testis biyopsilerinde az sayıda matür spermatid görülebilmektedir. Ejakulatta bir spermatozoanın çıkabilmesi için, testis biyopsisinde seminifer tubül başına en az 3 matür spermatidin gösterilmiş olması lazımdır. Bu şekilde germinal yetmezlikli azoospermi olgularının %50’sinden fazlasında, ejakulatlarında çıkmaya yetmeyecek derecede testislerinde spermatogenez devam edebilmektedir. Ne zaman ki seminifer tubül başına 3’den fazla matür spermatid yapılır, o zaman hastanın ejakulatında da sperm görülmeye başlar. Bu durumda artık azoospermi değil, oligozoospermi söz konusudur. Demek ki azoospermi diye yorumladığımız bazı olgular aslında oligozoosperminin ileri bir şeklidir.
Çoğu kez TESE sırasında sperm bulmak için geniş çapta biyopsiler alınmaktadır. Buda testisleri hasarlayarak daha sonra yapılacak girişimlerde sperm bulma şansını sıfırlayabilecektir. Bu nedenle iğne ile girilerek testislerden sperm elde edilmesine çalışılmışsa da, yapılan kontrollü çalışmalarda ileri derecede testiküler yetmezlik bulunan olgularda zaten az sayıda kalan spermatogenez odaklarına rastlanılma olasılığının çok az olduğu ve neticede açık biyopsi ile sperm elde edilebilecekken iğne ile elde edilemediği ortaya konmuştur.
Testislerde spermatogenezin fokal dağılım göstermesinin bilinmesi ve mikrocerrahi tekniğin buna eklenmesi ile mikrocerrahi-TESE yöntemi kullanılmaya başlanılmıştır. Böylece hem hücre bulma şansı artmakta hem de testis daha az travmatize edildiği için sonraki girişimlerde yeniden sperm bulma şansı devam edebilmektedir.
| Çoklu biyopsi (+) | Çoklu biyopsi (-) | |
| mikro-TESE (+) | 13 (%37) | 5 (%14) |
| mikro-TESE (-) | 0 | 17 (%49) |
Toplam 35 obstrüktif olmayan azoospermi olgusunda mikrocerrahi (mikro)TESE ve çoklu randomize testis biyopsisi ile en az bir tane spermatozoa elde edilen olgu sayıları (%). Randomize biyopsilerin alındığı ve TESE ile hücre elde edilemeyen olguların %14’ünde, mikro-TESE tekniği kullanıldığında spermatozoa bulunabilmektedir. (+) hücre var; (-) hücre yok. (Aydos K: Üroloji Bülteni 2001; 12: 181).
Testis biyopsilerinde spermatozoa, matür spermatid ve round spermatidin tanınması bazı durumlarda güçlük arz etmektedir. Histolojik incelemelerinde spermlerin kuyruğu nadiren görülebilir. Ayrıca, ince kesitlerde sadece kalın başı olan spermler görülebilir. Bu nedenle sıklıkla oval baş izlenir. TESE’de ise matür spermatid görünüm bakımından spermatozoadan fazla farklı değildir. Bir görüşe göre eğer TESE’de spermatozoa görülememiş ise round spermatid aramaya gerek yoktur çünkü matür spermatid bulunmayan hiçbir olguda round spermatidin de bulunmadığı ileri sürülmüştür (Silber SJ, Hum Reprod 1998; 13: 509).
Mikrocerrahi-TESE tekniğinde nonobstrüktif azoospermi olgularının yaklaşık %60’ında sperm elde edilebilmektedir. Sertoli cell only sendromu olgularında mikroskop altında yapılan diseksiyon sperm bulmak için sadece çok küçük bir parça doku çıkarılmasını mümkün kılmaktadır. Çünkü normal tubüller dolgun ve kalın görülürlerken, Sertoli cell only olgularında tubüller içi boş ve ince görünümdedirler. Oysa maturasyon arestli olgularda daha fazla miktarda testis dokusunun çıkarılması gerekir, çünkü genellikle bütün tubüller bir dereceye kadar dolgun ve kalındırlar. Bu nedenle normal spermatogenezin bulunduğu tubülleri diğerlerinden ayırt etmek güçtür. Yine de, testislere daha az zarar vermesi, kanamanın derhal kontrol edilmesi, kan dolaşımının bozulmaması, tunikanın ince sütür materyali ile dikilmesi nedeniyle kapanmasının doğala daha yakın olması ve nihayet kapatıldıktan sonra testis içi basıncın artmaması mikrocerrahi-TESE’yi üstün kılan özelliklerdir.
Nonobstrüktif azoospermi olgularında spermatogenez bölgesel (regional) dağılımdan çok, diffüz karakterde bir dağılım gösterir. Testis biyopsilerinde peşi sıra ince kesitlerin incelenmesi, spermatogenezin bu diffüz dağılımının düzenli olmadığını ve aralarındaki mesafelerin sürekli değişiklik gösterdiğini ortaya koymuştur. Zaten bu nedenle tek bir randomize biyopsi alındığında aynı testiste bile her zaman sperm bulunamayabilmektedir.
TESE sırasında çok büyük volümde doku çıkarılmasının gerektiği olgularda bile mikrocerrahi tekniğinin kullanılması bazı avantajlar sağlar. Çünkü testislerde hasarlanmanın asıl nedenleri seminifer tubülleri besleyen kan dolaşımının travmatize edilmesinden ya da daha sıklıkla tunik albuginea kapatıldıktan sonra testis içinde meydana gelen kanamaların testis içi basıncını artırmasından kaynaklanmaktadır. Tunika albuginea esnek olmayan bir yapıdadır. Testis içinde az miktarda bile olsa bir kanamanın gerçekleşmesi intratestiküler basınçta anlamlı bir artışa neden olur. TESE sırasında çok sayıda biyopsi alınan olgularda bu tablo ile sıklıkla karşılaşılmaktadır. Konvansiyonel TESE sırasında tunikanın kalın sütür materyalleri ile ve de sürekli tarzda dikilmesi, testis volümünü azaltarak, basınç artımına katkıda bulunur.
Mikroskopik testiküler sperm ekstraksiyonu tekniği: mikro-TESE
İşleme spinal kordun ve skrotal cildin yüzeyel lokal anestezileri yapılarak başlanılır. Takiben skrotal kesi ile testislere kadar ilerlenilir. Burada tek ya da iki taraflı kesi yapılması olgunun özelliğine ve cerrahın tercihine kalmıştır. Orta hat kesisi ile her iki testisi de aynı cilt kesisinden dışarı almak mümkündür. Ama bu yöntemde, geçilen tabakaların kalınlığı arttığı için kanama ve hematom riski daha fazla olabilmektedir. Tek taraflı kesiler daha az travmatik özelliktedir. Obstrüktif ya da hipospermatogeneze bağlı azoospermi olgularında, tek testisten sperm bulma olasılığı yüksek olduğu için, bunlarda tek taraflı kesi tercih edilebilir.
Arkasından, tunika vajinalis açılarak o taraf testis dışarı alınır. Öncelikle epididim ve vaz deferens obstrüktif bulgular ve konjenital anomaliler bakımından muayene edilmelidirler. Epididim tubüllerinin dolgun olması obstrüksiyonu düşündürmelidir. Tubül üzerinden küçük bir kesi yapılarak dışarı çıkan sıvı enjektöre çekildikten sonra, içinde uygun besi yeri bulunan bir konik tabanlı tüp içerisine taşınır. Burada amaç, eğer onarılamayacak bir obstrüksiyon bulunursa, alınan bu sperm hücrelerinin ICSI’de kullanılabilmesi için hazır tutulmasıdır. Arkasından, tüpteki sıvının bir damlası mikroskop altında incelenir ve eğer motil spermatozoa gözlenir ise olası bir obstrüksiyonun onarılması amacıyla vaz deferensin açıklılığının kontrol edilmesi gerekir. Vaz üzerinden yarı kalınlığı boyunca transvers bir kesi yapılarak lümeni görünür hale getirilir. Bu sırada lup ya da mikroskop kullanılması önerilir. 21g veya 23g bir anjioket yardımıyla lümene girilir. Lümenin travmatize edilmemesine büyük özen gösterilmelidir. Burada göz ameliyatlarında kullanılan ucu künt metal irrigasyon kanülleri son derece faydalı olur. İğneye takılı enjektörden izotonik serum yavaş yavaş gönderilir. Enjeksiyon sırasında parmağın basıncı iyi ayarlanmalıdır. Hızlı yapılırsa geri taşarak yanlışlıkla obstrüksiyon tanısı konulabilir. Yaklaşık 20 ml sıvı verilmelidir. Arada enjektör serbest bırakılarak pistonun basınç tepkisine bağlı olarak geriye doğru hareketi gözlenmelidir. Enjektörün artık ileri gitmemesi durumunda ya da pistonda geri basınç izlenirse, vaz boyunca bir tıkanıklığın varlığına karar verilir. Bu durumda aynı seansta distal kanal obstrüksiyonunun onarımına da geçilebilinir ya da daha önce alınmış olan spermatozoa kullanılarak ICSI yapılabilir. Eğer vaz deferensin açık olduğuna karar verilmişse, o zaman vaz üzerinden yapılmış olan transvers kesi tamamlanarak, uygun teknik yardımıyla vazo-epididimal anastomoz tamamlanır.
Epididimde dilatasyon yoksa ya da MESA sırasında motil spermatozoa bulunamamışsa TESE ile devam edilir.
Lup kullanılarak veya 20x büyütmeli ameliyat mikroskopu altında tunika albuginea üzerinde, avasküler bir alan seçilerek, ince bir bistüri ile 1-3 cm (testis volümüne göre değişir) uzunluğunda transvers bir kesi yapılır. Burada longitudinal kesi de tercih edilebilir. Çünkü mikroskopik TESE sırasında mümkün olduğunca fazla testis dokusu dışarı doğurtularak incelenmelidir. Ancak kendi gözlemlerimiz, transvers kesiden de yeteri genişlikte testis dokusunun doğurtulabildiğini göstermiştir. Transvers kesinin bir diğer avantajı ise subtunikal damarlara paralel bir kesi olması nedeniyle kanamanın daha az ortaya çıkmasıdır. İster longitudinal isterse transvers kesi tercih edilsin, başlangıçta kısa bir kesi yapılarak küçük bir testis dokusu kesilip laboratuvara gönderilmelidir. Eğer obstrüksiyona ya da hipospermatogeneze veya fokal spermatogenez odakları bulunan Sertoli cell sendromuna bağlı azoospermi varsa, bu parçadan da ICSI’de kullanılabilecek kalite ve miktarda spermatozoa elde edilebilinir. Zaten seminifer tubüllerin dolgunluğunun ve renginin gözlemlenmesi, bize matür spermatozoa içerip içermediği hakkında önceden bir fikir de verir. Bu doku parçasının laboratuvarda ayrıştırılması sonucu spermatozoa bulunamaz ise, kesi büyültülerek mikroskopik TESE ile devam edilir.
Tunika albugineanın kesilmesi sırasında sivri uçlu kornea bistürisi tercih edilmelidir. Ayrıca, bütün bu işlemler sırasında karşımıza çıkan damarlar çok dikkatli bir şekilde ve düşük voltajda koterize edilirler. Yine kendi tecrübelerimize göre, subtunikal damarların koterize edilmeyip küçük klempler yardımıyla tutulmalarının hem kanamayı durdurabildiği hem de kotere bağlı doku hasarlanmasını önlediği anlaşılmıştır. Mümkün olduğu kadar kansız bir ortamda çalışılmaya özen gösterilmelidir.
Daha sonra, dışarı doğurtulan testis dokusu incelenerek, seminifer tubuller mikrocerrahi aletleri kullanılarak muayene edilirler. Öncelikle, diğerlerinden farklı, dolgun, geniş ve opak seminifer tubüller ayırt edilerek, yeteri miktarda minimum doku atravmatize şekilde tutularak kesilir ve çıkarılır. İçerisinde sperm inkübasyon medyumu bulunan konik tabanlı bir tüp içerisine alınır. Androloji laboratuvarında bir Petri kutusuna nakledilen doku örneği, stereomikroskop altında tubüller diseke edildikten sonra inverted mikroskop ile (320x büyütme) spermatozoa varlığı yönünden tetkik edilir. Hücre bulunamaması durumunda örneklemeye devam edilmelidir. Hücre arama işlemlerine, aynı kesiden ya da diğer kesilerden alınan doku örneklerinde hücre bulunana kadar devam edilir. Gerekirse diğer testis de aynı şekilde araştırılır. Tubüllerin hepsinin de sklerotik olduğu ve diğerlerinden ayırt edilemediği durumlarda 0.5×0.5 cm testis dokusu randomize olarak seçilerek çıkarılır. Burada randomize seçilen 4 parça doku parçasının çıkarılmasının yeterli olacağı gösterilmiştir. Bunlar üst-alt kutuplardan ve iç-dış kenarlardan seçilir.
Spermatozoa bulunduğu zaman ya da bulunamaması durumunda yeteri kadar doku çıkarıldığına karar verildikten sonra, tunika albuginea 5/0 sütür ile kapatılır.
Bizim TESE uygulama sonuçlarımıza göre klasik çoklu-testis biyopsiler alınarak yapılan TESE yöntemiyle spermatozoa bulma oranları, mikrocerrahi yöntemle alınan (mikro-TESE) seminifer tubül örneklerinde spermatozoa bulma oranları karşılaştırıldığında, mikro-TESE’nin daha başarılı olduğu kanısı edinilmiştir (Aydos K: Üroloji Bülteni 2001; 12: 181). Çoklu randomize testis biyopsisi ile spermatozoa bulunan olguların tamamında mikro-TESE uygulaması ile de spermatozoa bulunmuştur. %14 olguda ise çoklu biyopside hücre görülemezken, mikro-TESE başarılı oldu. mikro-TESE ile spermatozoa bulma oranları, çoklu biyopsilemeden anlamlı derecede fazlaydı (%51’e karşılık %37) (p<0.05). Sertoli cell only, fokal germinal aplazi, maturasyon arresti ve hipospermatogenez bulunan olgularda mikro-TESE ve çoklu biyopsilemeden elde edilen hücre bulma oranları sırasıyla %22 – %11, %57 – %42, %42 – %14, %75 – %66 olmuştur. Çoklu biyopsileme yönteminde olguların %93’ünde her iki tarafta da spermatozoa bulunurken, %7’sinde sadece sağ tarafta spermatozoa vardı (p>0.05). mikro-TESE olgularınında sadece %5’inde bir tarafta hücre bulunamazken, karşı tarafta spermatozoa elde edilebildi.
Sonuç olarak bu çalışmamızdan elde edilen bulgular, azoospermi olgularında mikrocerrahi yöntemle yapılan TESE’nin, randomize çoklu testis biyopsilerine göre daha fazla oranda spermatozoa bulma şansı verebileceği; tanısal amaçlı testis biyopsisi neticesi germinal aplazi gelmesi durumunda da, TESE ile spermatozoa elde edilebileceği; ve tanımlanan yöntemle yapılan mikro-TESE’nin obstrüktif olmayan azoospermi olgularında hücre elde etmede daha etkili ve gerek çıkarılan doku hacminin azlığı, gerekse geride kalan testis dokusuna hemen hiç zarar vermemesi bakımlarından minimal invaziv bir yöntem olduğu kanısını vermektedir.
Çıkarılan testis dokusunun Androloji laboratuvarında mekanik ayrıştırma işlemi
Yukarıda tanımlandığı şekilde testis doku örnekleri elde edildikten sonra, laboratuvarda toplanan dokular, içerisinde 4 ml kültür ortamı (modifiye Eagle’s MEM mediumu, Sigma M2289; 15 mM HEPES, Sigma H6147; 1 mM pyruvic asid, Sigma P4562; 6 nM L-laktik asit, Sigma L7022; glutamin, Sigma G5763; 100 IU/ml penisilin, Sigma P4687; 100 mg/ml streptomisin, Sigma S1217; %10 (v/v) fetal bovin serumu, Sigma S9510) bulunan Petri kutusu içerisinde önce stereomikroskop altında iki küçük insülin iğnesi yardımıyla gerilerek parçalanır. Elde edilen eriyik konik tabanlı 15 ml Falcon tüp içerisine alınarak 1 dk süreyle vorteksleme işlemine tabi tutulur. Daha sonra 450 x g hızda 20 dk süreyle santrifüj edilir. Üstte kalan sıvı kısım bir pipet yardımıyla dışarı atılarak, dipte toplanan pelleti de içeren 0.5 ml’lik fraksiyon karıştırılır ve tekrar inversiyon mikroskopu altında x 320 büyütmede incelenir. Ancak burada bir diğer alternatif petri içinde dokuların ilk ayrıştırma işlemi yapıldıktan sonra, inversiyon mikroskopu altında spermatozoa aranması ve eğer görülmez ise, vorteks ve santrifüj işlemleri yapılmaksızın direkt enzimatik ayrıştırmaya geçilmesidir. Buradaki amaç vorteksleme ve santrifüj işlemlerine bağlı olarak ortama fazla miktarda toksik oksijen metabolitlerinin çıkmasına engel olmaktır.
Enzimatik ayrıştırma işlemi
Mekanik ayrıştırma ile spermatozoa görülemeyen olgularda doku süspansiyonu daha önce 37oC’a ısıtılmış enzim içeren 1 ml inkübasyon mediumu ile karıştırılarak bir Falkon tüp içerisine alınır ve 37oC’da, %5 CO2 ortamında 1 saat süreyle inkübe edilir (Crabbe E,et al: Hum Reprod 1997; 12: 1682). Burada kullanılan medium %1 HSA içeren HEPES’li Earle’s mediumu içine, 2.6 mg kollajenaz tip IV (Sigma C5138) ve ölü hücrelerden açığa çıkacak serbest DNA’ya bağlı hücre süspansiyonundaki pıhtılaşmayı önlemek amacıyla 25 mg/ml Dnase (Sigma DN25) konularak hazırlanır. İnkübasyon işlemi tamamlandıktan sonra solüsyon 50 x g‘de 5 dk santrifüj edilerek arta kalan doku parçalarının çökmesi sağlanılır. Üstteki kısım ayrı bir tüp içerisine alınır ve 400 x g‘de 5 dk süreyle tekrar santrifüj edilerek, dipte toplanan pellet kısmı inverted mikroskop altında incelenir. Elde edilen matür ve motil spermatozoalar ICSI’de kullanılmak üzere hazırlanılırlar.
Nonobstrüktif olduklarına karar verilmiş 153 olgunun incelendiği bir çalışmamızda, mekanik ayrıştırma sonucu en az bir spermatozoa bulunma oranı %36 olarak saptanmıştır (Aydos K: Klinik Bilimler 2001; 7: 636). Mekanik yöntem ile hücre bulunamayan 98 olgunun doku süspansiyonları enzimatik yöntem ile tekrar araştırıldığında ise, 19’unda daha (%19) spermatozoa bulunduğu gözlendi. Demekki sadece mekanik ayrıştırma yapılmış olsaydı, %19 olguda var olmasına rağmen spermatozoanın bulunmadığına karar verilecekti.
Sonuç olarak, ICSI yönteminin pratikte kullanımı infertilitenin tedavisinde yeni bir dönem başlatmıştır. Burada androloji ile uğraşan biz hekimlere düşen görev, yeteri matüritede ve sayıda germ hücresinin elde edilmesini sağlamaktır. Germ hücrelerinin matüritesinin sağlanması ise daha testis dokusu içerisindeyken uğraşılması gereken bir durumdur. Çünkü laboratuvardaki kültür koşulları henüz ideal olandan çok uzaktır. Örneğin kültür ortamları içerisine antioksidan veya FSH ya da testosteron eklenmesi henüz rutin uygulanıma girmemiştir. Oysa TESE öncesi in vivo olarak kullanılmaları yeterli intratestiküler konsantrasyonlarını elde etmeye yetebilir. Ayrıca, FSH replasmanı, östrojenlerin dengelenmesi, mikrosirkülasyonun düzenlenmesi gibi medikal tedavilerin, spermin kromozom yapısı üzerindeki olumlu etkileri yeni araştırılan ve ileriye yönelik ümit veren uygulamalardır. TESE öncesi FSH kullanılmasının seçilmiş olgularda hücre elde etme başarısını anlamlı derecede artırdığı yakın zamanda yayınlanmıştır (Aydos K, et al: Eur J Obst Gynecol Reprod Biol 2002). Böyle düşünülürse, TESE öncesi benzer tedavilerin geliştirilmesi ve belirli protokollere bağlanması hiç kuşkusuz fertilizasyon ve gebelik oranlarını da beraberinde yükseltebilecektir. Bu konuda daha fazla çalışmaların yapılması gerekir. Diğer yandan, TESE tekniğine ait prensipler de başarıda rol oynayan önemli faktörlerdir. Kullanılan bistüriden, mikroskop becerisine kadar her kademe, sonuç üzerinde etkilidir. Bütün bu veriler de Androloji’nin, her geçen gün ilgi alanı genişleyen ve yüz güldürücü sonuçlar veren bir bilim dalı olma özelliğini vurgular niteliktedir.