Prof.Dr. Kaan AYDOS
Azoospermi demek sperm tahlilinde hiç hücre görülmemesi anlamına gelir. Toplumdaki tüm erkeklerin yaklaşık %1’inde vardır. Çocuğu olmayanların ise hemen hemen %10-15’inde görülür. Yani nadir rastlanılan bir durum değildir. Azoosperminin nedenleri 2 gruba ayrılır:
1) Kanal tıkanıklığı
2) Testislerde sperm üretiminde bozukluk; diğer adıyla non-obstrüktif azoospermi (NOA)
Kanal tıkanıklığı, mikrocerrahi teknikle gayet başarılı bir şekilde tedavi edilebilir ve bu çiftler doğal yolla çocuk sahibi olabilirler. Testislerin çalışma bozukluğu olan grupta da, eğer neden hormon eksikliği ise, yine başarıyla tedavi edilip, doğal yolla çocuk sahibi olmak mümkündür. Ama geri kalan olgularda tedavi biraz sıkıntılı hal almakta.
MikroTESE tekniği ilk olarak 1993 yılında dünyada uygulanmaya başlandı. Böylelikle testislerde sperm üretimi bozuk bile olsa, hastaların yaklaşık yarısı, testislerinden ameliyatla canlı sperm elde edilerek tüp bebekle çocuk sahibi olmaya başladılar. Gerçekten de tıpta başarılmış en güzel gelişmelerden biridir mikroTESE ameliyatı. Ama geri kalan hastalarda ne yapılabilir? Yani, TESE ameliyatı ile testislerde sperm çıkmayan erkeklerde!.
Bu durumda TESE ile alınan dokularda tam olgunlaşmamış sperm serisi hücreler kullanılabilir. Spermler olgunlaşırken şu sırayı izlerler:
1) Spermatogonium: Bunlar kök hücreler olup, doğumdan ergenlik dönemine kadar testislerde kalır ve ergenlikteki hormonal değişimle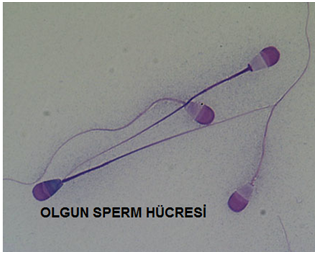 birlikte daha ileri olgunlaşma aşamalarına girerler. Ama bunların doğrudan çocuk yapma kapasiteleri yoktur.
birlikte daha ileri olgunlaşma aşamalarına girerler. Ama bunların doğrudan çocuk yapma kapasiteleri yoktur.
2) Spermatositler: Spermatogoniumlar olgunlaşmaya başladıklarında önce spermatositler oluşur. Bunlar da genetik olarak henüz doğrudan döllenme yapma kapasitesine sahip değildirler.
3) Spermatidler. Bunlar genetik olarak ikiye bölünmüş, yani döllenme yapabilme yoluna girmiş hücrelerdir. İşte, günümüzde pratik uygulamada gelinen son nokta, spermatidlerin tüp bebekte kullanılabilmesi uğraşısıdır.
4) Spermatozoa: Tam olgunlaşmasını tamamlamış, normal sperm hücresidir. Ejakulatta çıkıp, meni tahlillerinde görülen, işte bu hücrelerdir. Bunlar tüp bebekte büyük oranda gebelikle sonuçlanırlar. TESE’de de esas amaç bunları bulup, tüp bebeği bu hücrelerle gerçekleştirmektir.
İşte, eğer TESE ile testislerde olgun sperm hücresi olan spermatozoa bulunamazsa, bir önceki kademedeki spermatidlerin tüp bebekte kullanılması üzerinde çalışılmakta. Bunlardan alınan sonuçlar, olgun spermatozoalar kadar fazla değildir, daha düşüktür. Ama spermatidlerin de çeşitleri vardır ve başarılı olup olunamayacağı bunların tipine bağlıdır:
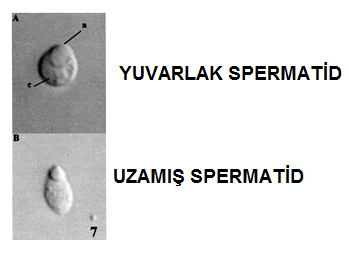
1) Yuvarlak spermatid (round spermatid)
2) Uzamakta olan ya da uzamış spermatid (elongating ya da elongated spermatid)
 Yapılan hayvan çalışmaları, her iki grup spermatidin de döllenme yaptığını ve gebelikle sonuçlandığını ortaya koymuştur. Bunun üzerine bilimadamları cesaretlenerek insanda da bunları kullanmayı denediler.
Yapılan hayvan çalışmaları, her iki grup spermatidin de döllenme yaptığını ve gebelikle sonuçlandığını ortaya koymuştur. Bunun üzerine bilimadamları cesaretlenerek insanda da bunları kullanmayı denediler.
1994 yılında Edwards adlı araştırıcı yuvarlak spermatidlerin de insanda kullanılabileceğini bildirdi. Bunu takiben 1995 yılında Tesarik adlı araştırıcı yuvarlak spermatid ile, Fishel de (1995) uzamış spermatid ile ilk gebelikleri başardılar.
Ancak bunu takip eden 15 yılda yuvarlak spermatidlerle elde edilen gebelik sayısı son derece düşük kaldı (Antinori 1997 ve Tesarik 1995).
Uzamış spermatidlerle alınan sonuçlar ise oldukça yüz güldürücüdür. Neredeyse normal olgunlukta sperm hücrelerinin, yani spermatozoanın kullanılmasıyla eşdeğer başarı elde edilebilmektedir. Bunlarla tüp bebek yapıldığı zaman hastaların yaklaşık üçte birinde (%28) çocuk sahibi olunabilmiştir. Netice olarak otörler, uzamış (elongated) spermatidlerin tüp bebekte kullanılmasını önermekteler (Sousa 2002). Değişik kliniklerden %15 ile %50 arasında değişen gebelik oranları bildirilmiştir (Sofikitis 1998 ve Vanderzwalmen 1997).
Bütün bu sonuçlara bakılınca, sorunun spermatid seçiminden kaynaklandığı anlaşılmakta. Eğer tam anlamıyla yuvarlak spermatidler seçilebilse, belki gebelik de sağlanabilecek. Gerçekten de, çok ileri lazer ya da büyütme teknikleri ile böyle bir seçimin yapılabileceği ileri sürülmüş, ancak klinikte uygulanamayacak kadar masraflı ve zahmetli olduğu sonucuna varılmıştır (Verheyen 1998 ve Yamanaka 1997).
Ancak, spermatidler haploid dediğimiz genetik yapıya sahip hücreler olduklarından, son yıllarda bu hücreleri genetik bazı tanı yöntemleri ile ayırt etmek mümkün olabilmektedir (Aydos 2013). Biz de TESE kararı verirken bu yöntemi kullanmaktayız.
Bunun üzerine araştırıcılar olgunlaşmamış sperm serisi hücreleri tedavi ile olgunlaştırma yollarını aramışlardır. Tedavide 2 yol vardır:
1) TESE ile çıkarılan dokular hormon içeren (FSH) kültür ortamında 2-3 gün bekletilir.
2) Erkeğe 3-6 ay süre ile hormon tedavisi verilerek, olgunlaşmamış sperm hücrelerinin olgunlaşması beklenebilir.
 Laboratuvarda hücrelerin geliştirilmesi seçeneği bazı merkezlerde denendi. Düşük oranda olsa da gebelik elde edileceği gösterildi. Ama henüz tam bir kanıya varmak için erken. Belki ileride daha kesin sonuçlar elde edilebilecek. Bu tekniği bazı olgularda biz de halen uygulamaktayız (Tesarik 1998a, 1998b, 1999a, 1999b, 2000).
Laboratuvarda hücrelerin geliştirilmesi seçeneği bazı merkezlerde denendi. Düşük oranda olsa da gebelik elde edileceği gösterildi. Ama henüz tam bir kanıya varmak için erken. Belki ileride daha kesin sonuçlar elde edilebilecek. Bu tekniği bazı olgularda biz de halen uygulamaktayız (Tesarik 1998a, 1998b, 1999a, 1999b, 2000).
Hastalara uzun süre hormon verilerek olgun sperm elde edilmesi ise daha güvenilir bir teknik. Gerçekten de farklı merkezlerde yapılan tedavilerde bu yöntemle olgun sperm elde edildiği ve gerek ejakulattan gerekse TESE ile testislerden elde edilecek spermlerle gebelik sağlandığı gösterilmiştir (Ramasamy 2009, Hussein 2005, Foresta 2004, Selman 2004, Efesoy 2009, Shiraishi 2009, Selman 2006). Biz de, testislerde sperm üretiminin bozulduğu ve olgun sperm çıkmayan erkeklerde en az 3 ay süreyle FSH stimülasyonu yapıldığında, olgun sperm bulma oranının %30 arttığını gördük ve buna dayanarak hastalarda bu tedaviyi uygulamaktayız (Aydos 2003).
Sonuç olarak; testislerde sperm üretiminin bozulduğu ve TESE ile olgun sperm hücresi bulunamayan erkeklerde, bazı özel yöntemler kullanılarak spermatidler tüp bebekte kullanılabilir. Bu yöntemler:
1) Azoospermik erkeğin TESE öncesinde hormonal tedaviye alınması.
2) Ejakulatta haploid hücrelerin çıktığının gösterilmesi.
3) TESE ile alınan dokularda, spermatid seçiminin çok dikkatli ve titiz biçimde, tecrübeli biyologlar tarafından yapılması.
Kaynaklar
Antinori S, Versaci C, Dani G, Antinori M, Pozza D, Selman HA. Fertilization with human testicular spermatids: four successful pregnancies. Hum Reprod. 1997;12:286–291.
Aydos K, Unlü C, Demirel LC, Evirgen O, Tolunay O. The effect of pure FSH administration in non-obstructive azoospermic men on testicular sperm retrieval. Eur J Obstet Gynecol Reprod Biol. 2003 May 1;108(1):54-8.
Aydos K, 2013. https://www.kaanaydos.com.tr/sperm-incelemesinde-haploid-hucre-bulunursa-tese-ile-olgun-sperm-bulma-olasiligi-da-var-demektir.html
Edwards RG, Tarin JJ, Dean N, Hirsch A, Tan SL. Are Spermatid Injections into Human Oocytes Now Mandatory. Hum Reprod. 1994;9(12):2217-9.
Efesoy O, Cayan S, Akbay E. The efficacy of recombinant human folliclestimulating hormone in the treatment of various types of male-factor infertility at a single university hospital. J Androl. 2009;30(6):679-84.
Fishel S, Green S, Bishop M, Thornton S, Hunter A, Fleming S, et al. Pregnancy after Intracytoplasmic Injection of Spermatid. Lancet. 1995;345(8965):1641-2.
Foresta C, Bettella A, Spolaore D, Merico M, Rossato M, Ferlin A. Suppression of the high endogenous levels of plasma FSH in infertile men are associated with improved Sertoli cell function as reflected by elevated levels of plasma inhibin B. Hum Reprod. 2004;19(6):1431-7.
Hussein A, Ozgok Y, Ross L, Niederberger C. Clomiphene administration for cases of nonobstructive azoospermia: a multicenter study. J Androl. 2005;26(6):787-91.
Ramasamy R, Ricci JA, Palermo GD, Gosden LV, Rosenwaks Z, Schlegel PN. Successful fertility treatment for Klinefelter’s syndrome. J Urol. 2009;182(3):1108-13.
Selman HA, Cipollone G, Stuppia L, De Santo M, Sterzik K, El-Danasouri I. Gonadotropin treatment of an azoospermic patient with a Ychromosome microdeletion. Fertility and sterility. 2004;82(1):218-9.
Selman H, De Santo M, Sterzik K, Cipollone G, Aragona C, El-Danasouri I. Rescue of spermatogenesis arrest in azoospermic men after long-term gonadotropin treatment. Fertil Steril. 2006;86(2):466-8.
Shiraishi K, Ohmi C, Shimabukuro T, Matsuyama H. Human chorionic gonadotrophin treatment prior to microdissection testicular sperm extraction in non-obstructive azoospermia. Hum Reprod. 2012;27(2):331-9.
Sofikitis NV, Yamamoto Y, Miyagawa I, et al. Ooplasmic injection of elongating spermatids for the treatment of non-obstructive azoospermia. Hum Reprod. 1998;13:709–714.
Sousa M, Cremades N, Silva J, Oliveira C, Ferraz L, Teixeira da Silva J, et al. Predictive value of testicular histology in secretory azoospermic subgroups and clinical outcome after microinjection of fresh and frozenthawed sperm and spermatids. Hum Reprod. 2002;17(7):1800-10.
Sousa M, Cremades N, Alves C, Silva J, Barros A. Developmental potential of human spermatogenic cells co-cultured with Sertoli cells. Hum Reprod. 2002 Jan;17(1):161-72/Resim.
Tesarik JN, Mendoza C, Testart J. Viable Embryos from Injection of Round Spermatids into Oocytes. New Engl J Med. 1995;333(8):525.
Tesarik J, Bahceci M, Ozcan C, Greco E, Mendoza C. Restoration of fertility by in-vitro spermatogenesis. Lancet. 1999;353(9152):555-6.
Tesarik J, Bahceci M, Ozcan C, Greco E, Mendoza C. In-vitro spermatogenesis – Reply. Lancet. 1999;353(9165):1708.
Tesarik J, Cruz-Navarro N, Moreno E, Canete MT, Mendoza C. Birth of healthy twins after fertilization with in vitro cultured spermatids from a patient with massive in vivo apoptosis of postmeiotic germ cells. Fertil Steril. 2000;74(5):1044-6.
Tesarik J, Greco E, Rienzi L, Ubaldi F, Guido M, Cohen-Bacrie P, et al. Differentiation of spermatogenic cells during in-vitro culture of testicular biopsy samples from patients with obstructive azoospermia: effect of recombinant follicle stimulating hormone. Hum Reprod. 1998;13(10): 2772-81.
Tesarik J, Guido M, Mendoza C, Greco E. Human spermatogenesis in vitro: respective effects of follicle-stimulating hormone and testosterone on meiosis, spermiogenesis, and Sertoli cell apoptosis. J Clin Endocrinol Metab. 1998;83(12):4467-73.
Vanderzwalmen P, Zech H, Birkenfeld A, et al. Intracytoplasmic injection of spermatids retrieved from testicular tissue: influence of testicular pathology, type of selected spermatids and oocyte activation. Hum Reprod. 1997;12:1203–1213.
Verheyen G, Crabbe E, Joris H, Van Steirteghem A. Simple and reliable identification of the human round spermatid by inverted phase-contrast microscopy. Hum Reprod. 1998;13(6):1570-7.
Yamanaka K, Sofikitis NV, Miyagawa I, Yamamoto Y, Toda T, Antypas S, et al. Ooplasmic round spermatid nuclear injection procedures as an experimental treatment for nonobstructive azoospermia. J Assist Reprod Gen. 1997;14(1):55-62.
Resim. http://sperm.abc.hu/en/fenymikr.htm

